
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
|
| A. | 常温常压下,32 g O2和O3的混合气体所含原子数为NA |
|
| B. | 标准状况下,1.8g的H2O中含有的电子数为NA |
|
| C. | 常温常压下,11.2L氧气所含的原子数为NA |
|
| D. | 10克氖气所含原子数约为6.02×1023 |
| 阿伏加德罗常数.. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | A、根据O2和O3均由氧原子构成来计算; B、根据n=来计算; C、常温常压下,气体摩尔体积不是22.4L/mol; D、根据氖气为氮原子分子来计算. |
| 解答: | 解:A、O2和O3均由氧原子构成,则32g混合气体中含有的氧原子的物质的量n== B、根据n=可知水的物质的量n= C、常温常压下,气体摩尔体积不是22.4L/mol,故11.2L氧气不是0.5mol,氧原子个数不是NA个,故C错误; D、10个氖气的物质的量n== 故选B. |
| 点评: | 本题考查了阿伏伽德罗常数的计算,掌握公式的使用和物质的结构是关键,难度不大. |


科目:高中化学 来源: 题型:
A、B、C是大家熟悉与生命运动密切相关的三种化合物,它们所含元素不超过三种,并有下列转化关系:
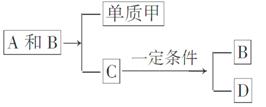
其中化合物D也是日常生活中常见的化合物,在一定条件下可与单质甲进一步发生如下变化:
D+3甲―→3A+2B
回答下列问题:
(1)在A、B、C、D四种化合物中,所含元素相同的是(写物质名称)________、________。
(2)常温下,A和B是通过什么途径转化为C的?
____________________________________________________。
(3)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良的影响,发生这种变化的主要原因是__________________
___________________________________________________________________________________________________________________。
(4)化合物D另有一种同分异构体,这种同分异构体的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是
,漂白粉在空气中易变质,反应的化学方程式为 。
制漂白粉的流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。
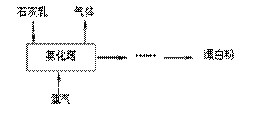 将含有3%~6%水分的熟石灰从塔顶喷洒而入,
将含有3%~6%水分的熟石灰从塔顶喷洒而入,
氯气从塔的最底层通入。这样加料的目的是
,处理从
氯化塔中逸出气体的试剂为 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是
,
其原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在①稀硫酸 ②液态HCl ③NaOH溶液 ④蔗糖晶体 ⑤Na3PO4固体⑥铜丝⑦液氨 ⑧酒精 ⑨熔融NaCl
上述状态下可导电的是 ①③⑥⑨ ;(填写序号,下同)属于非电解质的是 ④⑦⑧ ;上述状态下的电解质不能导电的是 ②⑤ .
(2)写出下列物质的电离方程式:
H2SO4 H2SO4═2H++SO42﹣ Ba(OH)2 Ba(OH)2=Ba2++2OH﹣ Na3PO4 Na3PO4=3Na++PO43﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.使用分光光度计,可以换算得到某溶液的浓度
B.氯碱工业:用离子交换膜电解槽电解时,往阳极室注入经过精制的 NaCl溶液,往阴极室注入稀氢氧化钠溶液
C.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
D.1fs(飞秒)=10-12s(秒)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列两种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;相同条件下,有关上述溶液的比较中,正确的是
A.溶液中的c(H+):①<②
B.分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<②
C.等体积的①、②溶液分别与足量铝粉反应,生成H2的量:②>①
D.向等体积的两种溶液中分别加入100 mL水后,溶液的pH:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用.下列叙述中错误的有
①汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
②人体中极少量的NO会促进血管扩张,防止血管栓塞
③工业上,焦炭在高温下还原二氧化硅得到粗硅,说明碳的还原性比硅强
④干冰或溴化银可用于人工降雨
⑤氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应”
⑥漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂
A.1个 B.2个 C.3个 D.5个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com