
| A的变化 量 |
| A的起始量 |
| (3-1.5)mol |
| 2L |
| △n |
| V×△t |
| A的变化 量 |
| A的起始量 |
| 1.5 |
| 3 |


科目:高中化学 来源: 题型:
| 族 周期 |
I A | II A | III A | IV A | VA | VI A | VII A |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
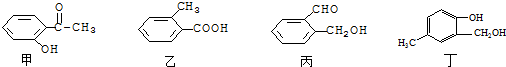
查看答案和解析>>
科目:高中化学 来源: 题型:
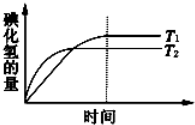 在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是
在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是查看答案和解析>>
科目:高中化学 来源: 题型:
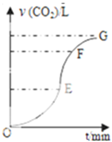 用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).
用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5L 0.1mol/L的NaCl溶液 |
| B、100mL 0.2mol/L的MgCl2溶液 |
| C、50mL 0.2mol/L的AlCl3溶液 |
| D、1L 0.5mol/L盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>③>④>② |
| B、②>③>④>① |
| C、①>④>②>③ |
| D、②>③>①>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com