
【题目】在下列各溶液中,一定能大量共存的离子组是
A.常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3-
B.滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3-
C.使石蕊呈红色的溶液:NH4+、NO3﹣、AlO2﹣、I﹣
D.常温下![]() =1014的溶液中:K+、Ba2+、Cl-、Br-
=1014的溶液中:K+、Ba2+、Cl-、Br-
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电、请完成以下与甲醇有关的问题:
(1)工业上有一种生产甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);ΔH=-49kJ·mol-1。在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g)+H2O(g);ΔH=-49kJ·mol-1。在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:

①从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为___。
②A中达到平衡时CO2的转化率为___。
③a=___。
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图:

①写出甲中通入甲醇这一极的电极反应式___。
②理论上乙中两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式___;在t2时所得溶液的pH约为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.HCO3- 在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①101kPa时,![]()
②稀溶液中,![]()
③![]() 时
时![]() 下列结论正确的是( )
下列结论正确的是( )
A.碳的燃烧热等于![]()
B.①的反应热为![]()
C.氢气的燃烧热等于![]()
D.浓硫酸与稀NaOH溶液反应生成![]() 水,放出
水,放出![]() 热量
热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液。
(1)若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为__mL。滴定终点时的现象是:当滴入最后一滴盐酸时,锥形瓶中溶液颜色由___,且30s不恢复原色。

(2)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠 溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据算出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=__mol·L-1。
(3)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是__(填字母)。
A.滴定前滴定管中有气泡,滴定后消失 B.碱式滴定管量取NaOH溶液时,未进行润洗操作
C.滴定时达到滴定终点时俯视读数 D.锥形瓶取用NaOH待测液前加少量水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
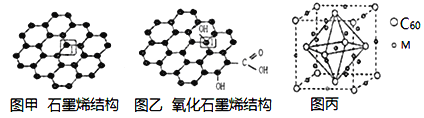
(1)图乙中1号C与相邻C有无形成π键__________(填“有”、或“无”)。
(2)图甲中1号C的杂化方式________。该C与相邻C形成的键角______(填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
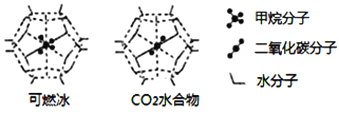
①“可燃冰”中分子间存在的2种作用力是_________;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各离子浓度关系正确的是
A.pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.浓度为0.1mol·L-1的碳酸钠溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.0.1mol·L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S)
D.醋酸溶液与NaOH溶液混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
已知HCO3-+AlO2-+H2O==CO32-+Al(OH)3↓。将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为
A.  B.
B.  C.
C.  D.
D. 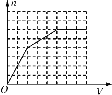
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列有关问题。
(1)甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
(2)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__,温度升高后,K值__(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__,温度升高后,K值__(填“增大”、“不变”或“减小”)。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为___。
②下列情况标志反应达到平衡状态的是__(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
d.容器内气体的平均相对分子质量保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com