
【题目】常温下,下列溶液中各离子浓度关系正确的是
A.pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.浓度为0.1mol·L-1的碳酸钠溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.0.1mol·L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S)
D.醋酸溶液与NaOH溶液混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
【答案】C
【解析】
A. 盐酸全部电离,pH=2时,则氢离子浓度为0.01mol/L,一水合氨为弱电解质部分电离,电离出的氢氧根离子的浓度为0.01mol/L,与盐酸等体积混合后,溶液显碱性;
B.根据物料守恒,可知![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3);
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3);
C.根据溶液中电荷守恒c(Na+) +c(H+)= c(OH-)+c(HS-)+2c(S2-),物料守恒c(Na+)= c(H2S)+c(HS-)+c(S2-),求解可得c(OH-)=c(H+)-c(S2-)+c(H2S);
D.根据溶液中电荷守恒,c(Na+) +c(H+)=c(CH3COO-) -c(OH-),溶液呈中性,则c(OH-)=c(H+),解得c(Na+) =c(CH3COO-);
A. 盐酸全部电离,pH=2时,则氢离子浓度为0.01mol/L,一水合氨为弱电解质部分电离,电离出的氢氧根离子的浓度为0.01mol/L,与盐酸等体积混合充分反应后,氨水过量溶液显碱性,c(OH-)大于c(H+),A错误;
B.根据物料守恒,可知![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),B错误;
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),B错误;
C. 根据溶液中电荷守恒c(Na+) +c(H+)= c(OH-)+c(HS-)+2c(S2-),物料守恒c(Na+)= c(H2S)+c(HS-)+c(S2-),求解可得c(OH-)=c(H+)-c(S2-)+c(H2S),C正确;
D. 根据溶液中电荷守恒,c(Na+) +c(H+)=c(CH3COO-) -c(OH-),溶液呈中性,则c(OH-)=c(H+),解得c(Na+) =c(CH3COO-),D错误;
答案为C。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】我国钛资源丰富,攀枝花和西昌已探明钛矿储量就有几十亿吨,其重要的矿石有金红石![]() 、钛铁矿
、钛铁矿![]() 以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
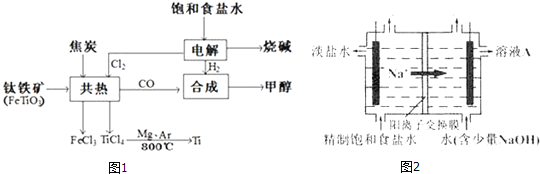
![]() 常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出
常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出![]() 水解的方程式 ______
水解的方程式 ______
![]() 写出钛铁矿与焦炭、
写出钛铁矿与焦炭、![]() 共热得到
共热得到![]() 的化学方程式: ______
的化学方程式: ______
![]() ①
① ![]()
②![]()
请写出上图中![]() 生成Ti的热化学反应方程式: ______
生成Ti的热化学反应方程式: ______
![]() 海绵钛可用碘提纯,原理为
海绵钛可用碘提纯,原理为![]()
![]() 下列说法正确的是 ______
下列说法正确的是 ______
A 该反应正反应的![]()
B 在不同温度区域,![]() 的量保持不变
的量保持不变
C 在提纯过程中,![]() 的作用是将粗钛从低温区转移到高温区
的作用是将粗钛从低温区转移到高温区
D 在提纯过程中,![]() 可循环利用
可循环利用
![]() 钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
①该电解装置阳极在 ______ ![]() 填左室、右室
填左室、右室![]() 氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
②右室中加入少量NaOH的原因是 ______ .
![]() 在上述产业链中合成112t甲醇理论上能生产Ti ______
在上述产业链中合成112t甲醇理论上能生产Ti ______ 不考虑生产过程中物质的任何损失
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为
,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为![]() ;辛烷的燃烧热为
;辛烷的燃烧热为![]() 下列热化学方程式书写正确的是( )
下列热化学方程式书写正确的是( )
A.![]()
B.![]()
C.![]()
![]()
![]()
![]()
D.![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,一定能大量共存的离子组是
A.常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3-
B.滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3-
C.使石蕊呈红色的溶液:NH4+、NO3﹣、AlO2﹣、I﹣
D.常温下![]() =1014的溶液中:K+、Ba2+、Cl-、Br-
=1014的溶液中:K+、Ba2+、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是______________________;
(2)该化合物的分子式为____________;
(3)该化合物1分子中存在1个苯环,且在核磁共振氢谱图中有4组吸收峰。试写出它可能的结构简式_______________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以CH3OH和空气为原料的燃料电池,电解质为KOH溶液。回答下列问题:
① OH-移向____________极。
② 负极反应式为__________________________________。
③ 电池中pH将逐渐______________(填增大、减少、不变)。
(2)用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电一段时间后, e极增重0.064g。则
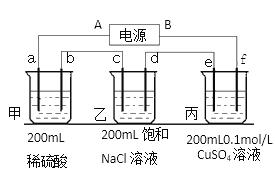
①电源B极是____________极。
②甲池a电极反应式为 ___________________________________________。
③乙池反应化学方程式________________________________________________。
④乙池共可收集到标准状况下气体体积为_____________mL,乙溶液的pH为___________。(常温,不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式分别为:
H2 (g) +![]() O2(g) = H2O (l) △H = -285.8 kJ /mol
O2(g) = H2O (l) △H = -285.8 kJ /mol
CO(g) +![]() O2(g) = CO2(g) △H = -283 kJ /mol
O2(g) = CO2(g) △H = -283 kJ /mol
C8H18 (l) +![]() O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
CH4 (g) + 2O2(g) = CO2(g) + 2H2O (l) △H = -890.3 kJ /mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2 (g)B.CO(g)C.C8H18 (l)D.CH4 (g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.![]() 时,将
时,将![]() 的碳酸钠溶液加水稀释100倍,所得溶液的
的碳酸钠溶液加水稀释100倍,所得溶液的![]()
B.pH相同的盐酸和醋酸溶液分别与足量镁粉反应,醋酸产生![]() 体积更大
体积更大
C.![]() 时,
时,![]() 的HA弱酸溶液与
的HA弱酸溶液与![]() 的NaOH溶液等体积混合,所得溶液pH一定小于7
的NaOH溶液等体积混合,所得溶液pH一定小于7
D.![]() 溶液中加入一定量
溶液中加入一定量![]() 晶体,溶液中
晶体,溶液中![]() 增大,可以证明
增大,可以证明![]() 为弱酸
为弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com