
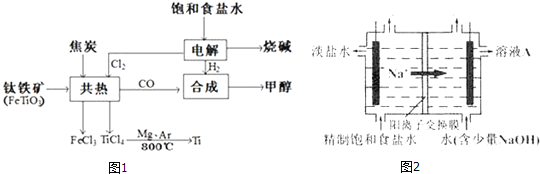
【题目】我国钛资源丰富,攀枝花和西昌已探明钛矿储量就有几十亿吨,其重要的矿石有金红石![]() 、钛铁矿
、钛铁矿![]() 以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
![]() 常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出
常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出![]() 水解的方程式 ______
水解的方程式 ______
![]() 写出钛铁矿与焦炭、
写出钛铁矿与焦炭、![]() 共热得到
共热得到![]() 的化学方程式: ______
的化学方程式: ______
![]() ①
① ![]()
②![]()
请写出上图中![]() 生成Ti的热化学反应方程式: ______
生成Ti的热化学反应方程式: ______
![]() 海绵钛可用碘提纯,原理为
海绵钛可用碘提纯,原理为![]()
![]() 下列说法正确的是 ______
下列说法正确的是 ______
A 该反应正反应的![]()
B 在不同温度区域,![]() 的量保持不变
的量保持不变
C 在提纯过程中,![]() 的作用是将粗钛从低温区转移到高温区
的作用是将粗钛从低温区转移到高温区
D 在提纯过程中,![]() 可循环利用
可循环利用
![]() 钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
①该电解装置阳极在 ______ ![]() 填左室、右室
填左室、右室![]() 氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
②右室中加入少量NaOH的原因是 ______ .
![]() 在上述产业链中合成112t甲醇理论上能生产Ti ______
在上述产业链中合成112t甲醇理论上能生产Ti ______ 不考虑生产过程中物质的任何损失
![]()
【答案】极性共价键 ![]()
![]()
![]()
![]()
![]()
![]()
![]() CD 左室 金属钛不易被腐蚀,生产的
CD 左室 金属钛不易被腐蚀,生产的![]() 不会与之反应 增强导电性 56
不会与之反应 增强导电性 56
【解析】
![]() 在常温下是无色液体,应属于分子晶体;
在常温下是无色液体,应属于分子晶体;![]() 水解生成
水解生成![]() 和HCl,依据原子个数守恒写出方程式;
和HCl,依据原子个数守恒写出方程式;
![]() 钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO;
钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO;
![]() 依据热化学方程式和盖斯定律计算得到所需热化学方程式;
依据热化学方程式和盖斯定律计算得到所需热化学方程式;
![]() A. 依据反应类型判断反应的热效应;
A. 依据反应类型判断反应的热效应;
B. 根据温度判断,在不同温度区域,![]() 的量是否发生改变;
的量是否发生改变;
C. 温度不同,反应方程式不同,产物不同;
D. 在提纯过程中,根据反应确定![]() 的量是否变化;
的量是否变化;
![]() 依据溶液中阳离子的移动方向判断电极;金属钛稳定性强于铁,抗氯气的腐蚀能力强于铁;
依据溶液中阳离子的移动方向判断电极;金属钛稳定性强于铁,抗氯气的腐蚀能力强于铁;
![]() 氢氧化钠为强电解质,加入后能够增强电解质溶液的导电能力;
氢氧化钠为强电解质,加入后能够增强电解质溶液的导电能力;
![]() 依据转化关系:
依据转化关系:![]() ,
,![]() ;
;![]() 计算解答。
计算解答。
![]() 在常温下是无色液体,应属于分子晶体,含有的化学键为极性共价键;
在常温下是无色液体,应属于分子晶体,含有的化学键为极性共价键;![]() 水解生成
水解生成![]() 和Cl,化学方程式:
和Cl,化学方程式:![]()
![]()
![]() ;故答案为:极性共价键;
;故答案为:极性共价键;![]()
![]()
![]() ;
;
![]() 钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO,该反应为
钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO,该反应为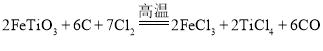 ,故答案为:
,故答案为: ;
;
![]()
![]()
由盖斯定律![]() ,得到热化学方程式为:
,得到热化学方程式为:![]() ;故答案为:
;故答案为:![]() ;
;
![]() A. 大多数混合反应是放热反应,该反应的正反应也是放热反应,则该反应正反应的
A. 大多数混合反应是放热反应,该反应的正反应也是放热反应,则该反应正反应的![]() ,故A错误;
,故A错误;
B. 高于![]() ,钛和氯气反应生成四氯化钛,在
,钛和氯气反应生成四氯化钛,在![]() 四氯化钛分解,所以在不同温度区域,
四氯化钛分解,所以在不同温度区域,![]() 的量不同,故B错误;
的量不同,故B错误;
C. 在提纯过程中,高于![]() ,碘和钛反应生成四氯化钛,在
,碘和钛反应生成四氯化钛,在![]() 四氯化钛分解生成碘和钛,所以
四氯化钛分解生成碘和钛,所以![]() 的作用是将粗钛从低温区转移到高温区,故C正确;
的作用是将粗钛从低温区转移到高温区,故C正确;
D. 在提纯过程中,高于![]() ,碘和钛反应生成四氯化钛,在
,碘和钛反应生成四氯化钛,在![]() 四氯化钛分解生成碘和钛,所以
四氯化钛分解生成碘和钛,所以![]() 的量不变,可以循环利用故D正确;
的量不变,可以循环利用故D正确;
故选:CD;
![]() 钠离子为阳离子,电解池中阳离子移向的极为阴极,所以右室为阴极,左室为阳极;金属钛不易被腐蚀,生产的
钠离子为阳离子,电解池中阳离子移向的极为阴极,所以右室为阴极,左室为阳极;金属钛不易被腐蚀,生产的![]() 不会与之反应,抗腐蚀性强与铁,所以氯碱工业电解槽一般采用Ti网作阳极而不用Fe网;故答案为:左室;金属钛不易被腐蚀,生产的
不会与之反应,抗腐蚀性强与铁,所以氯碱工业电解槽一般采用Ti网作阳极而不用Fe网;故答案为:左室;金属钛不易被腐蚀,生产的![]() 不会与之反应;
不会与之反应;
![]() 氢氧化钠为强电解质,加入后能够增强电解质溶液的导电能力;故答案为:增强导电性;
氢氧化钠为强电解质,加入后能够增强电解质溶液的导电能力;故答案为:增强导电性;
![]() 依据转化关系可知:
依据转化关系可知:
![]()
![]()
![]()
112t m
则有![]() ,解得
,解得![]() ,故答案为:56t。
,故答案为:56t。


科目:高中化学 来源: 题型:
【题目】下列反应中,相关示意图像错误的是:
A.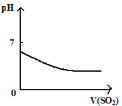 将二氧化硫通入到一定量氯水中
将二氧化硫通入到一定量氯水中
B.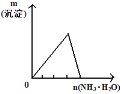 将氨水滴入到一定量氯化铝溶液中
将氨水滴入到一定量氯化铝溶液中
C.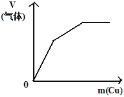 将铜粉加入到一定量浓硝酸中
将铜粉加入到一定量浓硝酸中
D.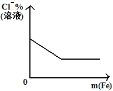 将铁粉加入到一定量氯化铁溶液中
将铁粉加入到一定量氯化铁溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电、请完成以下与甲醇有关的问题:
(1)工业上有一种生产甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);ΔH=-49kJ·mol-1。在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g)+H2O(g);ΔH=-49kJ·mol-1。在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:

①从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为___。
②A中达到平衡时CO2的转化率为___。
③a=___。
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图:

①写出甲中通入甲醇这一极的电极反应式___。
②理论上乙中两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式___;在t2时所得溶液的pH约为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3H2O⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(1)③溶液中离子浓度大小顺序为______________________。用离子方程式表示⑦溶液显碱性的原因_______________________________。
(2)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=____________。已知常温下⑤和⑥的电离常数均为1.7×10-5 mol·L-1,则反应:CH3COOH+NH3H2O![]() CH3COO-+NH4++H2O的平衡常数为______________。
CH3COO-+NH4++H2O的平衡常数为______________。
(3)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是________。
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(4)常温下,将0.10 mol/L的①溶液和0.30 mol/L;②溶液等体积混合,充分反应后恢复至常温,溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 实验室利用如右图装置进行中和热的测定。回答下列问题:
(1)该图中有一处未画出,它是_____________(填仪器名称)。
(2)某同学利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,最终测得中和热△H=-55.2kJ/mol。已知标准中和热为△H=-57.3kJ/mol,导致这一偏差的原因最不可能的是________(填字母序号)。
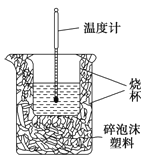
a.实验装置保温、隔热效果差
b.在量取盐酸溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
Ⅱ. 某同学用0.1000mol·L-1的标准NaOH溶液滴定未知浓度的醋酸,其操作为如下几步。请回答:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线下,并记下读数4.60mL
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
(1)以上步骤有一步错误,该错误操作会导致测定结果_______(填“偏大”“偏小”或“不变”)
(2)如下图1是某次滴定时滴定管中的终点液面,则该次测得的醋酸物质的量浓度为_____
(3)如下图2所示为滴定图象,a、b、c、d四点中,水的电离程度最大的是 ______点。
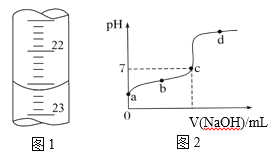
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国规定生活用水中镉排放的最大允许浓度为0.005mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=___。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,则它们在水中的溶解能力较大的是___。
(3)在某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol/L时,水体中Cd2+浓度为___mol/L,(已知:Ksp(CdS)=7.9×1027),此时是否符合水源标准?______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.HCO3- 在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各离子浓度关系正确的是
A.pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.浓度为0.1mol·L-1的碳酸钠溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.0.1mol·L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S)
D.醋酸溶液与NaOH溶液混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com