
【题目】根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3H2O⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(1)③溶液中离子浓度大小顺序为______________________。用离子方程式表示⑦溶液显碱性的原因_______________________________。
(2)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=____________。已知常温下⑤和⑥的电离常数均为1.7×10-5 mol·L-1,则反应:CH3COOH+NH3H2O![]() CH3COO-+NH4++H2O的平衡常数为______________。
CH3COO-+NH4++H2O的平衡常数为______________。
(3)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是________。
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(4)常温下,将0.10 mol/L的①溶液和0.30 mol/L;②溶液等体积混合,充分反应后恢复至常温,溶液的pH=________。
【答案】c(Cl-)>c(NH4+)>c(H+)>c(OH-) CO32-+H2O![]() HCO3-+OH- 1×10-3 mol/L 2.89×104 D 13
HCO3-+OH- 1×10-3 mol/L 2.89×104 D 13
【解析】
(1)NH4Cl为强酸弱碱盐,水解呈酸性;Na2CO3为强碱弱酸盐,水解呈碱性;
(2)CH3COONa为强碱弱酸盐,水解促进水的电离,醋酸抑制水的电离;
将反应CH3COOH+NH3H2O![]() CH3COO-+NH4++H2O的化学平衡常数表达式进行变形,带入CH3COOH和NH3H2O的电离平衡常数,就可得到反应的化学平衡常数的数值;
CH3COO-+NH4++H2O的化学平衡常数表达式进行变形,带入CH3COOH和NH3H2O的电离平衡常数,就可得到反应的化学平衡常数的数值;
(3)根据HCl是强酸,完全电离,CH3COOH是弱酸,部分电离,结合水电离平衡的影响因素分析判断;
(4)根据二者反应的物质的量关系,可知NaOH过量,溶液显碱性,然后计算反应后溶液中c(OH-),结合水的离子积常数及pH定义,计算溶液的pH。
(1)氯化铵为强酸弱碱盐,在溶液中电离NH4Cl=NH4++Cl-,NH4+发生水解反应,消耗水电离产生的OH-,最终达到平衡时溶液中c(H+)>c(OH-);水解呈酸性,铵根离子水解反应而消耗,所以c(Cl-)>c(NH4+),盐电离产生的NH4+浓度大于水电离产生的H+浓度,所以溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
Na2CO3为强碱弱酸盐,在溶液中CO32-发生水解反应:CO32-+H2O![]() HCO3-+OH-,水解产生的HCO3-会进一步水解:HCO3-+H2O
HCO3-+OH-,水解产生的HCO3-会进一步水解:HCO3-+H2O![]() H2CO3+OH-,主要是第一步水解反应。水解反应消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),所以水解后溶液呈碱性;
H2CO3+OH-,主要是第一步水解反应。水解反应消耗水电离产生的H+,最终达到平衡时,溶液中c(OH-)>c(H+),所以水解后溶液呈碱性;
(2)CH3COONa为强碱弱酸盐,pH=11的CH3COONa溶液中,c(H+)=10-11mol/L,由于在室温下水的离子积常数Kw=1×10-14,所以c(OH-)=![]() mol/L=1×10-3mol/L,溶液中OH-就是水电离产生,即CH3COONa溶液中,由水电离出来的c(OH-)=1×10-3mol/L,
mol/L=1×10-3mol/L,溶液中OH-就是水电离产生,即CH3COONa溶液中,由水电离出来的c(OH-)=1×10-3mol/L,
反应CH3COOH+NH3H2O![]() CH3COO-+NH4++H2O的平衡常数K=
CH3COO-+NH4++H2O的平衡常数K=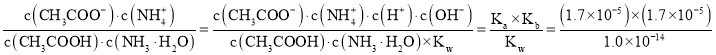 =2.89×104;
=2.89×104;
(3)HCl、CH3COOH 溶液的pH相同,则溶液中c(H+)相同,对水的电离平衡的抑制作用也相同,因此这两种溶液中水的电离程度相同,A正确;
B.在HCl、CH3COOH 溶液中都存在电荷守恒,两种溶液的pH相同,则两种溶液中c(H+)、c(OH-)也就相同,所以根据电荷守恒可知溶液中c(CH3COO-)=c(Cl-),B正确;
C.由于醋酸是弱酸,部分电离存在电离平衡,所以溶液中c(CH3COOH)>c(H+),而HCl是一元强酸,完全电离,溶液中c(H+)=c(HCl),所以pH相同的两种溶液中c(CH3COOH)> c(HCl),C正确;
D.由于溶液中的电解质的浓度c(CH3COOH)> c(HCl),所以与等浓度的氢氧化钠溶液反应,醋酸消耗NaOH的体积多,D错误;
故合理选项是D;
(4)HCl与NaOH混合会发生反应:HCl+NaOH=NaCl+H2O,二者反应的物质的量的比是1:1,常温下,将0.10 mol/L的HCl溶液和0.30 mol/L的NaOH溶液等体积混合,碱过量,溶液显碱性,混合后溶液中c(OH-)=![]() mol/L=0.10mol/L,由于在常温下Kw=1×10-14,所以溶液中c(H+)=1×10-13mol/L,因此该溶液的pH=13。
mol/L=0.10mol/L,由于在常温下Kw=1×10-14,所以溶液中c(H+)=1×10-13mol/L,因此该溶液的pH=13。


科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 烯中C=C的键能是乙烷中C-C的键能的2倍
B. 氮气分子中含有1个s键和2个p键
C. N-O键的极性比C-O键的极性大
D. NH4+中4个N-H键的键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构如图所示,下列说法正确的是( )

A. 该物质遇FeCl3溶液显紫色,属于苯酚的同系物
B. 1mol该物质分别与浓溴水和NaOH溶液反应时最多消耗Br2和NaOH均为4mol
C. 滴入酸性KMnO4溶液振荡,紫色褪去即证明该物质结构中存在碳碳双键
D. 该分子中所有碳原子均可能位于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
2Z(g)+W(g);△H=QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是( )
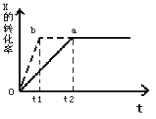
A. 降低温度B. 增大Y的浓度
C. 加入催化剂D. 增大体系压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国钛资源丰富,攀枝花和西昌已探明钛矿储量就有几十亿吨,其重要的矿石有金红石![]() 、钛铁矿
、钛铁矿![]() 以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
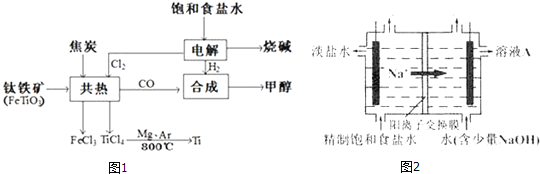
![]() 常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出
常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出![]() 水解的方程式 ______
水解的方程式 ______
![]() 写出钛铁矿与焦炭、
写出钛铁矿与焦炭、![]() 共热得到
共热得到![]() 的化学方程式: ______
的化学方程式: ______
![]() ①
① ![]()
②![]()
请写出上图中![]() 生成Ti的热化学反应方程式: ______
生成Ti的热化学反应方程式: ______
![]() 海绵钛可用碘提纯,原理为
海绵钛可用碘提纯,原理为![]()
![]() 下列说法正确的是 ______
下列说法正确的是 ______
A 该反应正反应的![]()
B 在不同温度区域,![]() 的量保持不变
的量保持不变
C 在提纯过程中,![]() 的作用是将粗钛从低温区转移到高温区
的作用是将粗钛从低温区转移到高温区
D 在提纯过程中,![]() 可循环利用
可循环利用
![]() 钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
①该电解装置阳极在 ______ ![]() 填左室、右室
填左室、右室![]() 氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
②右室中加入少量NaOH的原因是 ______ .
![]() 在上述产业链中合成112t甲醇理论上能生产Ti ______
在上述产业链中合成112t甲醇理论上能生产Ti ______ 不考虑生产过程中物质的任何损失
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Ni(OH)2]=2.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。将含Fe2O3、Ag、Ni的某型废催化剂溶于盐酸,过滤,滤渣为Ag,所得溶液中c(Ni2+)=c(Fe3+)=0.4mol/L。向该溶液中滴加一定浓度的NaOH溶液(假设溶液体积不变)。下列说法中正确的是
A.金属活动性:Ag>Ni
B.加入NaOH溶液时,先产生Ni(OH)2沉淀
C.当滴定到溶液pH=5时,溶液中lg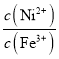 约为10
约为10
D.当滴定到溶液呈中性时,Ni2+已沉淀完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为原子序数依次增大的四种短周期元素。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素,Z元素原子的最外层电子数是其电子层数的2倍。下列说法不正确的是
A.X与W形成化合物与稀盐酸反应不可能产生氧气
B.原子半径:X>Y>Z>W
C.简单氢化物的稳定性:W>Z>Y
D.Y与W形成化合物能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是______________________;
(2)该化合物的分子式为____________;
(3)该化合物1分子中存在1个苯环,且在核磁共振氢谱图中有4组吸收峰。试写出它可能的结构简式_______________、_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com