
【题目】我国规定生活用水中镉排放的最大允许浓度为0.005mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=___。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,则它们在水中的溶解能力较大的是___。
(3)在某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol/L时,水体中Cd2+浓度为___mol/L,(已知:Ksp(CdS)=7.9×1027),此时是否符合水源标准?______(填“是”或“否”)。
【答案】c3(Cd2+)·c2 (PO43-) Cd(OH)2 1.0×10-19 是
【解析】
(1)Ksp为生成离子浓度幂之积;
(2)沉淀类型不相同,结合Ksp计算溶解度;
(3)根据Ksp确定Cd2+浓度,再转化为mg/L,若离子浓度小于0.005mg/L即可判断合格。
(1)根据磷酸镉[Cd3(PO4)2]沉淀溶解平衡,可知其沉淀溶解平衡常数的表达式Ksp=c3(Cd2+)c2(PO43-);
(2)当CdCO3达到沉淀溶解平衡时有CdCO3(s)![]() Cd2+(aq)+CO32-(aq),则其达到平衡时,溶液中Cd2+的浓度c(Cd2+)=
Cd2+(aq)+CO32-(aq),则其达到平衡时,溶液中Cd2+的浓度c(Cd2+)=![]() =2.0×10-6mol/L,当Cd(OH)2达到沉淀溶解平衡时有Cd(OH)2(s)
=2.0×10-6mol/L,当Cd(OH)2达到沉淀溶解平衡时有Cd(OH)2(s)![]() Cd2+(aq)+2OH-(aq),则平衡时溶液中Cd2+的浓度c(Cd2+)=
Cd2+(aq)+2OH-(aq),则平衡时溶液中Cd2+的浓度c(Cd2+)=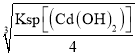 =2×10-5mol/L>2×10-6mol/L,说明两种物质在水中的溶解能力较大的是Cd(OH)2;
=2×10-5mol/L>2×10-6mol/L,说明两种物质在水中的溶解能力较大的是Cd(OH)2;
(3)当S2-浓度达到7.9×10-8mol/L时,Cd2+浓度为c(Cd2+)=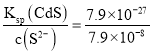 mol/L=1.0×10-19mol/L=1019mol/L×112g/mol×103mg/g=1.12×1014mg/L<0.005mg/L,因此符合水源标准,答案为是。
mol/L=1.0×10-19mol/L=1019mol/L×112g/mol×103mg/g=1.12×1014mg/L<0.005mg/L,因此符合水源标准,答案为是。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】向2L密闭容器中充入2molSO2和一定量的O2,发生反应:2SO2(g)+O2(g)![]() 2 SO3(g),当反应进行到4min时,测知SO2为0.4mol,当反应进行到2min时,密闭容器中SO2物质的量为
2 SO3(g),当反应进行到4min时,测知SO2为0.4mol,当反应进行到2min时,密闭容器中SO2物质的量为
A.等于1.2molB.小于1.2molC.大于1.2molD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构如图所示,下列说法正确的是( )

A. 该物质遇FeCl3溶液显紫色,属于苯酚的同系物
B. 1mol该物质分别与浓溴水和NaOH溶液反应时最多消耗Br2和NaOH均为4mol
C. 滴入酸性KMnO4溶液振荡,紫色褪去即证明该物质结构中存在碳碳双键
D. 该分子中所有碳原子均可能位于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国钛资源丰富,攀枝花和西昌已探明钛矿储量就有几十亿吨,其重要的矿石有金红石![]() 、钛铁矿
、钛铁矿![]() 以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
![]() 常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出
常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出![]() 水解的方程式 ______
水解的方程式 ______
![]() 写出钛铁矿与焦炭、
写出钛铁矿与焦炭、![]() 共热得到
共热得到![]() 的化学方程式: ______
的化学方程式: ______
![]() ①
① ![]()
②![]()
请写出上图中![]() 生成Ti的热化学反应方程式: ______
生成Ti的热化学反应方程式: ______
![]() 海绵钛可用碘提纯,原理为
海绵钛可用碘提纯,原理为![]()
![]() 下列说法正确的是 ______
下列说法正确的是 ______
A 该反应正反应的![]()
B 在不同温度区域,![]() 的量保持不变
的量保持不变
C 在提纯过程中,![]() 的作用是将粗钛从低温区转移到高温区
的作用是将粗钛从低温区转移到高温区
D 在提纯过程中,![]() 可循环利用
可循环利用
![]() 钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
①该电解装置阳极在 ______ ![]() 填左室、右室
填左室、右室![]() 氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
②右室中加入少量NaOH的原因是 ______ .
![]() 在上述产业链中合成112t甲醇理论上能生产Ti ______
在上述产业链中合成112t甲醇理论上能生产Ti ______ 不考虑生产过程中物质的任何损失
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Ni(OH)2]=2.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。将含Fe2O3、Ag、Ni的某型废催化剂溶于盐酸,过滤,滤渣为Ag,所得溶液中c(Ni2+)=c(Fe3+)=0.4mol/L。向该溶液中滴加一定浓度的NaOH溶液(假设溶液体积不变)。下列说法中正确的是
A.金属活动性:Ag>Ni
B.加入NaOH溶液时,先产生Ni(OH)2沉淀
C.当滴定到溶液pH=5时,溶液中lg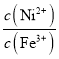 约为10
约为10
D.当滴定到溶液呈中性时,Ni2+已沉淀完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的化工原料F(C5H8O4)有特殊的香味,可通过如图所示的流程合成:

已知:①X是石油裂解气主要成分之一,与乙烯互为同系物;
② ;
;
③C、E、F均能与NaHCO3生成气体
(1)D中所含官能团的名称是_______________。
(2)反应②的化学方程式为_____________,反应类型是________;反应⑥的化学方程式为______________。
(3)F的同分异构体很多,其中一种同分异构体只含有一种官能团,在酸性或碱性条件下都能水解生成两种有机物,该同分异构体的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为原子序数依次增大的四种短周期元素。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素,Z元素原子的最外层电子数是其电子层数的2倍。下列说法不正确的是
A.X与W形成化合物与稀盐酸反应不可能产生氧气
B.原子半径:X>Y>Z>W
C.简单氢化物的稳定性:W>Z>Y
D.Y与W形成化合物能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为
,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为![]() ;辛烷的燃烧热为
;辛烷的燃烧热为![]() 下列热化学方程式书写正确的是( )
下列热化学方程式书写正确的是( )
A.![]()
B.![]()
C.![]()
![]()
![]()
![]()
D.![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以CH3OH和空气为原料的燃料电池,电解质为KOH溶液。回答下列问题:
① OH-移向____________极。
② 负极反应式为__________________________________。
③ 电池中pH将逐渐______________(填增大、减少、不变)。
(2)用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电一段时间后, e极增重0.064g。则
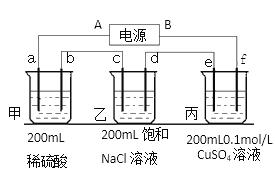
①电源B极是____________极。
②甲池a电极反应式为 ___________________________________________。
③乙池反应化学方程式________________________________________________。
④乙池共可收集到标准状况下气体体积为_____________mL,乙溶液的pH为___________。(常温,不考虑溶液体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com