
【题目】下列说法正确的是![]()
A.![]() 时,将
时,将![]() 的碳酸钠溶液加水稀释100倍,所得溶液的
的碳酸钠溶液加水稀释100倍,所得溶液的![]()
B.pH相同的盐酸和醋酸溶液分别与足量镁粉反应,醋酸产生![]() 体积更大
体积更大
C.![]() 时,
时,![]() 的HA弱酸溶液与
的HA弱酸溶液与![]() 的NaOH溶液等体积混合,所得溶液pH一定小于7
的NaOH溶液等体积混合,所得溶液pH一定小于7
D.![]() 溶液中加入一定量
溶液中加入一定量![]() 晶体,溶液中
晶体,溶液中![]() 增大,可以证明
增大,可以证明![]() 为弱酸
为弱酸
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各离子浓度关系正确的是
A.pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.浓度为0.1mol·L-1的碳酸钠溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.0.1mol·L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S)
D.醋酸溶液与NaOH溶液混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中将2molNaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量(n)的取值范围是( )
A. n≥1 B. 1<n<2 C. 2≤n<4 D. n≥4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列有关问题。
(1)甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
(2)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__,温度升高后,K值__(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__,温度升高后,K值__(填“增大”、“不变”或“减小”)。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为___。
②下列情况标志反应达到平衡状态的是__(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
d.容器内气体的平均相对分子质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是________。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.500mL容量瓶 c.玻璃棒 d.滴定管
(2)已知不同杂质离子开始沉淀和沉淀完全的pH如下:

加入NH3·H2O调节pH=8可除去_______ (填离子符号),此时,溶液中该离子的浓度为_______mol·L-1。加入NaOH调pH=12.5,溶液内剩余的阳离子中_______完全沉淀,_____________ (填离子符号)部分沉淀。加入H2C2O4时应避免过量,原因是___________。(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9, Ksp[Fe(OH)3] =2.6×10-39)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.pH=1的硫酸溶液1L,溶液中含SO42-的数目等于0.1NA
B.真空密闭容器中充入0.1molH2和0.1molI2充分反应后,容器内分子总数为0.2NA
C.10mL0.1molL-1的FeCl3与20mL0.1molL-1KI溶液反应,转移电子数为0.001NA
D.60gSiO2晶体中Si-O键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3 个能级,且毎个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出D基态的价层电子排布图:_____。
(2)下列说法正确的是_____。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成如图所示的离子,该离子中碳原子的杂化方式是______。
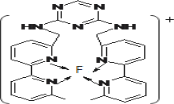
(4)己知(BC)2是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为______。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是______。
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_____,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=______pm。(写出计算表达式)
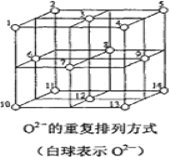
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是
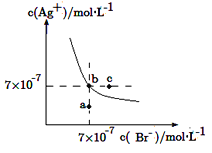
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=________ mol·L-1;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=_________ mol·L-1。
(2)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到白色沉淀生成。将此混合液过滤,向滤渣中加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________, 反应的离子方程式为______________________。
(3)下列说法不正确的是_____________。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比![]() 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
(4)25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①![]() 的电离常数表达式 K =_____________。
的电离常数表达式 K =_____________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com