
【题目】现有A、B、C、D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3 个能级,且毎个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出D基态的价层电子排布图:_____。
(2)下列说法正确的是_____。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成如图所示的离子,该离子中碳原子的杂化方式是______。
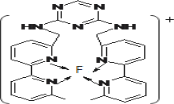
(4)己知(BC)2是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为______。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是______。
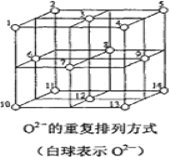
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_____,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=______pm。(写出计算表达式)
【答案】![]() B sp 2、sp 3 3:4 HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近 2∶1 50%
B sp 2、sp 3 3:4 HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近 2∶1 50% ![]()
【解析】
A、B、C、D、E、F原子序数依次增大的六种元素,均位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同,核外电子排布为1s22s22p2,故B为碳元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,二者只能处于第四周期,且E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则E为Fe,F为Cu,(3)中C(氮元素)与A形成的气体x,则A为H元素,形成的x为NH3,据此解答本题。
(1)(1)D为O元素,价电子排布为2s22p4,基态的价层电子排布图为:![]() ,
,
故答案为:![]() ;
;
(2)A、二氧化硅属于原子晶体,二氧化碳形成分子晶体,故点:SiO2>CO2,故A错误;
B、同周期自左而右电负性增大,电负性顺序:C<N<O<F,故B正确;
C、N2与CO为等电子体,氮气分子中N原子之间形成3对共用电子对,化学性质稳定,CO还原性较强,二者化学性质不同,故C错误;
D、水分子间存在氢键,影响物理性质,不影响化学性质,由于非金属性O>S,所以稳定性:H2O>H2S,故D错误,
故答案为:B;
(3)杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,甲基、亚甲基上碳原子含有4个共价单键,采用sp3杂化,
故答案为:sp2、sp3;
(4)(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N,单键为σ键,三键含有1个σ键、2个π键,(CN)2中σ键和π键的个数比为3:4,
故答案为:3:4;
(5)HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近,
故答案为:HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近;
(6)结构中如1、3、6、7的O2围成的正四面体空隙有8个,由图可知晶体结构中O2离子数目为8×![]() +6×
+6×![]() =4个,则正四面体空隙数与O2离子数目之比为8:4=2:1;
=4个,则正四面体空隙数与O2离子数目之比为8:4=2:1;
Fe3O4中有一半的Fe3+填充到正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则有50%的正八面体空隙没有填充阳离子;
含有Fe3+和Fe2+的总数为3,晶胞中有8个图示结构单元,不妨取1mol这样的晶胞,则1mol晶胞的质量为m=8×(3×56+4×16)g=8×232g,1mol晶胞即有6.02×1023个晶胞,1个晶胞的体积为V=(a×1010)3cm3,所以晶体密度为 ,所以晶胞边长a=
,所以晶胞边长a=![]() pm,
pm,
故答案为:2:1;50;![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)以CH3OH和空气为原料的燃料电池,电解质为KOH溶液。回答下列问题:
① OH-移向____________极。
② 负极反应式为__________________________________。
③ 电池中pH将逐渐______________(填增大、减少、不变)。
(2)用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电一段时间后, e极增重0.064g。则
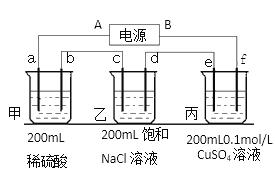
①电源B极是____________极。
②甲池a电极反应式为 ___________________________________________。
③乙池反应化学方程式________________________________________________。
④乙池共可收集到标准状况下气体体积为_____________mL,乙溶液的pH为___________。(常温,不考虑溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+5D反应中,表示该反应速率最快的是
3C+5D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s)B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s)D.υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.![]() 时,将
时,将![]() 的碳酸钠溶液加水稀释100倍,所得溶液的
的碳酸钠溶液加水稀释100倍,所得溶液的![]()
B.pH相同的盐酸和醋酸溶液分别与足量镁粉反应,醋酸产生![]() 体积更大
体积更大
C.![]() 时,
时,![]() 的HA弱酸溶液与
的HA弱酸溶液与![]() 的NaOH溶液等体积混合,所得溶液pH一定小于7
的NaOH溶液等体积混合,所得溶液pH一定小于7
D.![]() 溶液中加入一定量
溶液中加入一定量![]() 晶体,溶液中
晶体,溶液中![]() 增大,可以证明
增大,可以证明![]() 为弱酸
为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A.在纯水中加入少量硫酸铵,可抑制水的电离.
B.升高温度,活化分子百分数一定增大,化学反应速率一定增大
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.虽然固体氯化钠不能导电,但氯化钠是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物X由4种元素组成,某学习小组进行了如下实验:
![]()
已知:步骤②中消耗KI0.15mol
请回答:
(1)X的化学式是___,黄色溶液乙与SO2反应的离子方程式是___。
(2)X中一种元素对应的单质,与足量的K2CO3溶液反应得到的产物中含溶液甲中溶质,写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com