
【题目】在一定条件下,某密闭容器中,可逆反应:N2 (g) +3H2(g) ![]() 2NH3 (g)达到化学反应限度的标志是
2NH3 (g)达到化学反应限度的标志是
A. 正、逆反应速率都等于零 B. N2、H2、NH3在容器中共存
C. N2、H2、NH3的浓度不再变化 D. N2、H2、NH3的分子数之比为1:3:2
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用激光照射硫酸铜溶液可以观察到丁达尔现象
B.钠与氧气反应的产物与反应条件无关
C.燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
D.利用氯气单质的氧化性可以把碘离子转化为碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是()
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在空气中的燃烧产物是二氧化硫,在纯氧气中的燃烧产物是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 16g CH4含有的原子数为NA
B. 17 g OH- 含有的质子数为9NA
C. 2g D2气体中含有的中子数为0.5 NA
D. 标准状况下22.4 L NH3含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于离子键、共价键的各种叙述中,说法正确的是( )
A.在离子化合物中,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子中
C.在共价化合物分子内,一定不存在离子键
D.由不同元素组成的多原子分子里,一定只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:
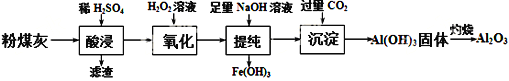
(1) “酸浸”时需加入过量的稀硫酸,写出Al2O3溶解的离子方程式___________________。
(2)证明酸浸后溶液中存在Fe3+的方法是:取酸浸后的溶液少许置于试管中,向其中滴加硫氰化钾溶液,溶液变为血红色;再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去,继续滴加会有气泡逸出,该气体会使带火星的木条复燃。
①红色变深的原因是(用离子方程式表示):_____________________________;
②溶液红色褪去是由于过氧化氢氧化了硫氰根离子,已知双氧水氧化SCN—生成N2、CO2和SO42-,写出该反应的离子方程式:____________________________;
③有气体逸出,说明Fe3+对H2O2的分解有催化作用,写出催化过程第一步反应的离子方程式________________________________。

(3) “提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=___________。将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为______________。
(4) “沉淀”过程中,通入过量CO2时发生反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_____________________________________________,所得溶液中c(H+)- c(OH-)=___________________________(填写表达式)

(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如右图所示(电极材料为石墨)。
① 图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②SO32-放电的电极反应式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com