
【题目】下列实验方案合理的是( )
A. 可用酸性高锰酸钾溶液除去甲烷中混有的杂质乙烯
B. 可用溴水鉴别己烯、己烷和四氯化碳
C. 制备氯乙烷:将乙烷和氯气的混合气放在光照条件下反应
D. 证明溴乙烷与NaOH醇溶液共热生成了乙烯:用如图所示的实验装置

科目:高中化学 来源: 题型:
【题目】下列实验方案中不能达到相应实验目的的是
选项 | A | B | C | D |
方案 |
|
|
|
|
目的 | 探究浓度对化学反应速率的影响 | 探究催化剂对H2O2分解速率的影响 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
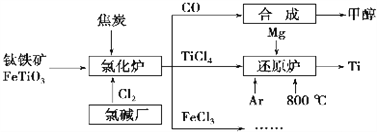
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶ 6,则氯化炉中的化学方程为_________________________________________________。
(3)TiCl4在常温下为无色液体,在军事上可作为人造烟雾剂,因为它在湿空气中会大冒白烟,水解生成二氧化钛的水凝胶TiO2·xH2O(也常写成H2TiO),工业上可也用此反应制备TiO2。请写出该水解方程式__________________________________________(用TiO2·xH2O或H2TiO表示均可),工业上用TiCl4制备TiO2·xH2O时要加入大量的水,同时加热,目的是:______________________________
(4)Ar气通入还原炉中并不参与反应,通入Ar气的作用是__________________________
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-= 2CO32-+6H2O,工作一段时间后,测得溶液的pH_____(填“减小”、“增大”或“不变”)。
(6)FeCl3溶液可作为印刷电路铜板的腐蚀液,写出该反应的离子方程式_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) △H3=-285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=_____________kJ/mol。
(2)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________。
(3)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A. C2H4、C2H6O B. C2H6、C2H6O C. C3H6、C2H4 D. C3H4、C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是中学化学中常见且重要的一类反应,回答下列问题:
(1)下列金属单质参加的化学反应都是氧化还原反应,都是金属失电子。
①相同质量的钠分别与氧气反应,全部生成氧化钠和全部生成过氧化钠两种情况下转移的电子数目之比是________;
②分别取W克钠、铁、铝与足量的盐酸反应,失去电子的物质的量之比是________;③分别取含0.1mol H2SO4的稀硫酸和含0.1mol NaOH的氢氧化钠溶液于两支试管中,分别加入足量的铝粉充分反应,产生氢气 (同温同压下)的体积之比是________。
(2)某氧化还原反应的反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2转化为氧气。
①该反应中的还原剂是____________;
②如果化学方程式中Cr(OH)3和H2O2的物质的量之比为2:3,写出该反应的化学方程式,并标出电子转移的方向和数目_________________;
③如果反应中转移了3a mol电子,则产生的气体在标准状况下体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. AgNO3+NaCl===AgCl↓+NaNO3 B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. 2F2+2H2O===4HF+O2 D. MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下:
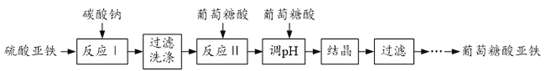
(1)反应Ⅰ的化学方程式为______。
(2)①碳酸亚铁过滤时需在表面保留水层的原因是______;
②检验FeCO3已经洗涤干净的操作为______。
(3)反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是______。
(4)葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是( )
A. HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol。则H2SO4和Ba(OH)2反应的中和热△H=2×(﹣57.3) kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8 kJ/mol,则C2H5OH(l)+3O2(g) ═ 2CO2(g)+3H2O(g) 反应的△H=-1366.8 kJ/mol
C. 一定条件下2SO2(g)+O2(g)![]() 2SO3(g) △H1<0,2SO2(g)+O2(g)
2SO3(g) △H1<0,2SO2(g)+O2(g)![]() 2SO3(l) △H2<0,则△H1>△H2
2SO3(l) △H2<0,则△H1>△H2
D. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣38.6kJ/mol
2NH3(g) △H=﹣38.6kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com