
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)锌为活泼金属,加入硫酸铜发生Zn+CuSO4=ZnSO4+Cu,置换出铜;
(2)Cu、Zn、硫酸形成原电池反应,会使得化学反应速率加快;
(3)能与锌发生置换反应且能形成原电池反应的有Cu(NO3)2、FeSO4、AgNO3,硝酸根与氢离子使溶液有强氧化性,会生成氮的氧化物;
(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等;
(5)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同;
②生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
解答 解:(1)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,此外金属锌会和硫酸之间发生反应Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的有Cu(NO3)2、FeSO4、AgNO3,硝酸根与氢离子使溶液有强氧化性,会生成氮的氧化物,则只有FeSO4符合,
故答案为:FeSO4;
(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,
故答案为:升高反应温度;适当增加硫酸的浓度;
(5)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml,而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=20ml-10ml=10ml,V9=20ml-2.5ml=17.5ml,
故答案为:30;10;17.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(5)小题,首先V6、V9的求得要注意分析表中数据;最后一问应该能够想到“覆盖”的问题,题目难度中等.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )| A. | 对应简单离子半径:Z>X>W | |
| B. | 对应气态氢化物的稳定性Y>Z | |
| C. | 化合物XZW既含离子键,又含共价键 | |
| D. | Y的氧化物既能与Z的氢化物溶液反应,又能与X的最高价氧化物对应水化物的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与稀硫酸反应生成氢气 | |
| B. | 铁与水反应生成氢氧化铁和氢气 | |
| C. | 钠投入CuSO4溶液中,可以置换出铜 | |
| D. | 某溶液与铝反应产生氢气,该溶液不一定是酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
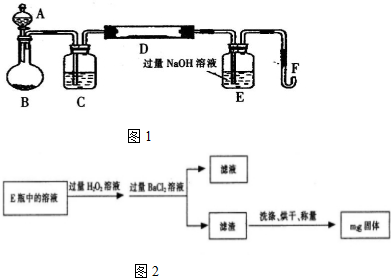
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②④⑤ | B. | ②①④⑤③ | C. | ②④①⑤③ | D. | ④⑤②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
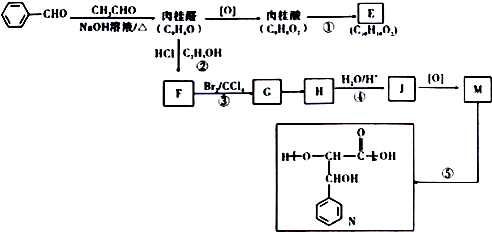
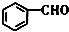 的名称是苯甲醛.
的名称是苯甲醛.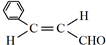 ,分子中最多有18个原子共平面.
,分子中最多有18个原子共平面. .
.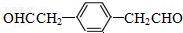 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
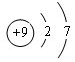 .
.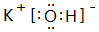 ;其中所含化学键的类型离子键、共价键.
;其中所含化学键的类型离子键、共价键.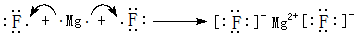 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com