
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰: 4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)Mn3+基态价层电子排布图为________。
(2)Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序__________。从电子云重叠的方式看N中存在的化学键类型有__________。
(3)与NO2-互为等电子体的一种分子的化学式为________。
(4)1molCH3COOH中含有的σ键数目为___________。CH3COOH分子通过氢键形成环状二聚物,写出含氢键表示的环状二聚物的结构简式___________。
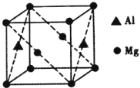
(5)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为_________。镁铝合金密度为ρg/cm3,则该晶胞的边长为__________nm(阿伏加德罗常数的值为N)。
【答案】![]() N >O> H σ键、
N >O> H σ键、![]() 键 O3或SO2 7NA
键 O3或SO2 7NA 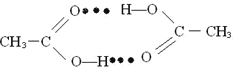 8
8 ![]() × l07
× l07
【解析】
(1)Mn是25号元素,Mn的价层电子排布式为[Ar]3d54s2,Mn3+的价层电子排布式为[Ar]3d4,其基态价层电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)Mn(NO3)2·6H2O中非金属元素有N、O、H,一般地,元素的非金属性越强,第一电离能越大,所以N、O的第一电离能比H大。N、O位于相同周期,N的2p轨道为半充满状态,N比O稳定,失去一个电子N比O难,所以N的第一电离能比O的第一电离能大,综上所述,三者的第一电离能从大到小为:N >O> H。硝酸根离子中的键是由N-Oσ键和一个4原子6电子的离域大π键构成的,故答案为:N >O> H;σ键、![]() 键;
键;
(3)价电子数和原子数相同的分子、离子或基团互为等电子体,可用S或者O替换N,同时去掉得到的一个电子,即O3或SO2,故答案为:O3或SO2;
(4)单键全是σ键,双键含一个σ键一个π键,所以1mol CH3COOH中含7mol的σ键,即σ键数为7NA。一个CH3COOH分子羧基中的O和另一个CH3COOH分子羧基中的H之间形成氢键,所以,2分子CH3COOH可通过氢键形成八元环的二聚物,结构简式为: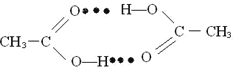 ,故答案为:7NA;
,故答案为:7NA;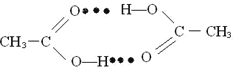 ;
;
(5)每个铝原子周围距离最近的镁原子有8个,距离为面对角线长的一半。由均摊法可知,1个晶胞中Al的个数=2×![]() =1,Mg的个数=8×
=1,Mg的个数=8×![]() +2×
+2×![]() =2,那么1个晶胞的质量=
=2,那么1个晶胞的质量=![]() g,设晶胞边长为a,1个晶胞的体积a3=
g,设晶胞边长为a,1个晶胞的体积a3=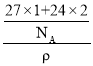 ,所以,边长a=
,所以,边长a=![]() cm=
cm=![]() × l07nm,故答案为:8;
× l07nm,故答案为:8;![]() × l07。
× l07。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图实验装置,将液体A逐滴加入到固体B中,下列叙述正确的是

A. 若A为H2O2,B为MnO2,C中Na2S溶液变浑浊
B. 若A为浓盐酸,B为MnO2,C中KI淀粉溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中AlCl 3溶液先产生白色沉淀后 沉淀又溶解
D. 若A为浓盐酸 ,B为CaCO3,C中Na2SiO3 溶液出现白色沉淀,则非金属性C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
B. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
D. 39g钾与氧气完全反应,生成K2O转移NA个电子,生成KO2转移2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为-393.5 kJ/mol、-285.8 kJ/mol、-870.3 kJ/mol,则![]() CH3COOH(l)═C(s)+H2(g)+
CH3COOH(l)═C(s)+H2(g)+![]() O2(g)的反应热为( )
O2(g)的反应热为( )
A.-191 kJ/molB.+191 kJ/molC.+244.15 kJ/molD.+488.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用镁屑与液溴为原料制备无水MgBr2, 装置如图, 主要步骤如下:

步骤1组装好仪器,向三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2 。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁, 加热至160℃分解得无水Mg Br2产品。
已知:①Mg和Br2反应剧烈放热;Mg Br2具有强吸水性。
②MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5
③乙醚是重要有机溶剂,医用麻醉剂;易挥发储存于阴凉、通风处;易燃远离火源。
请回答下列问题:
(1)写出步骤2的操作是_________。
(2)仪器A的名称是__________。装置中碱石灰的作用__________。冰水浴的目的__________。
(3)该实验从安全角度考虑除了控制反应温度外,还需要注意:
①_________②_______。
(4)制备MgBr2装置中橡胶塞和用乳胶管连接的玻璃管口都要用锡箔纸包住的目的是_________。
(5)有关步骤4的说法,正确的是__________。
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度,可用EDTA(简写为Y4-) 标准溶液滴定,反应的离子方程式:Mg2+ +Y4-═MgY2-
①先称取0.7500g无水MgBr2产品,溶解后,等体积分装在3只锥形瓶中, 用0.0500mol·L-1的EDTA标准溶液滴定至终点,三次消耗EDTA标准溶液的体积平均为26.50mL, 则测得无水MgBr2产品的纯度是_______(保留4位有效数字)。
②滴定前未用标准溶液润洗滴定管,则测得产品纯度___________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼元素为人体及动植物必须的微量元素,也在钢铁工业中有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是
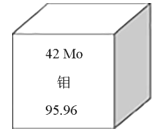
A.95Mo18O42-(钼酸根离子)中共计有76个电子
B.Mo元素是第五周期的主族元素
C.92Mo、95Mo、98Mo互为同位素,化学性质几乎相同
D.98Mo的原子核内中子数比质子数多14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线 a 表示放热反应X(g)+Y(g) ![]() Z(g) + M(g) + N(s)进行过程中 X 的转化率随时间变化的关系。若要改变起始条件,使反应过程按 b 曲线进行,可采取的措施是( )
Z(g) + M(g) + N(s)进行过程中 X 的转化率随时间变化的关系。若要改变起始条件,使反应过程按 b 曲线进行,可采取的措施是( )
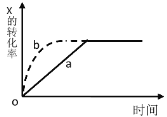
A.升高温度B.加大 X 的投入量
C.加催化剂D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g)![]() bZ(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
bZ(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a=l,b=2 B. a=2,b=1 C. a=2,b=2 D. a=3,b=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )

A.该反应的有机生成物有四种,都为液体B.该反应的条件是光照,但是不能放在日光直射的地方
C.该反应属于取代反应D.该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com