
【题目】(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
①基态Fe3+的M层电子排布式为 .
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 . 已知该晶胞的密度为ρ g/cm3 , 阿伏加德罗常数为NA , 求晶胞边长a= cm.(用含ρ、NA的计算式表示)
(3)下列有关的说法正确的是 .
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为 , 1mol Y2X2含有σ键的数目为
②化合物ZX3的沸点比化合物YX4的高,其主要原因是 .
③元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 .
【答案】3s23p63d5;5;分子晶体;立方体;![]() ?;BC;sp杂化;3 NA或3×6.02×1023个;NH3分子存在氢键;N2O
?;BC;sp杂化;3 NA或3×6.02×1023个;NH3分子存在氢键;N2O
【解析】(1)①Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2 , Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+ , Fe3+电子排布式为1s22s22p63s23p63d5 , 则M层电子排布式为:3s23p63d5 ,
所以答案是:3s23p63d5;
②配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,
所以答案是:5;分子晶体;
(2)距一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体,该晶胞中钠离子个数是8,氧离子个数=8×![]()
![]() =4,V=
=4,V=![]() =
=![]() =
=![]() cm3 , 则a=
cm3 , 则a=![]() cm,
cm,
所以答案是:立方体;![]() ;
;
(3)A.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素,所以第一电离能大小:P>S>Si,故A错误;
B.同一周期元素中,元素的电负性随着原子序数的增大而增大,所以电负性顺序:C<N<O<F,故B正确;
C.晶格能与离子晶体的熔点成正比,离子半径与晶格能成反比,离子所带电荷与晶格能成正比,钙离子电荷大于钾离子,且钙离子半径小于钾离子,氯离子所带电荷小于氧离子,且氯离子半径大于氧离子,所以氯化钾的晶格能小于氧化钙,则氯化钾的熔点比氧化钙低,故C正确;
D.二氧化硫分子中硫原子的价层电子对是3且含有一个电子对,所以二氧化硫是V形结构,为极性分子,二氧化碳是非极性分子,根据相似相溶原理知,二氧化硫易溶于水,故D错误;
E.分子晶体中,物质的熔沸点与其相对分子质量成正比,故D错误;
所以答案是:BC;
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素,W的原子序数为29,则W是Cu元素.
①Y2X2是乙炔,分子式为C2H2 , 碳氢原子之间存在σ键,碳碳三键中含有一个σ键,所以每个碳原子含有2个σ键,采取sp杂化,一个乙炔分子中含有3个σ键,所以1mol Y2X2含有σ键3mol,即为3 NA或3×6.02×1023个,
所以答案是:sp杂化;3 NA或3×6.02×1023个;
②N原子电负性较大,C原子电负性较小,所以氨气分子中存在氢键,甲烷分子中不含氢键,氢键的存在导致氨气的沸点大于甲烷,
所以答案是:NH3分子存在氢键;
③CO2和N2O的原子个数相等、价电子数相等,所以是等电子体,所以答案是:N2O.
【考点精析】解答此题的关键在于理解晶体的类型与物质熔点、硬度、导电性等的关系的相关知识,掌握不同晶体类型的物质:原子晶体>离子晶体>分子晶体;同种晶体类型的物质:晶体内微粒间的作用力越大,溶、沸点越高.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如下:

(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
方法 | 是否正确 | 简述理由 |
方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
你认为最合理的其他方法是: (四) | ||
(一)__________________________________________________;
(二)__________________________________________________;
(三)__________________________________________________;
(四)__________________________________________________。
(2)框图中加入的试剂①应该是________(填化学式);加入的试剂②是________(填化学式);工业上由无水MgCl2制取镁的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③
C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
(1)基态硅原子的电子排布式
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷中硅采取 杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 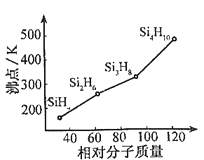
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为 .(用元素符号表示)
(4)气态SeO3分子的立体构型为 ,与SeO3互为等电子体的一种离子为 (填化学式).
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞棱长为a pm,则该合金密度为 g/cm3 . (列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
A.a反应:Fe2++2H++H2O2=Fe3++2H2O
B.b反应:HCO3-+OH-=CO32-+H2O
C.c反应:H++OH-=H2O
D.d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2﹣和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 .
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 .
(3)X与Z中电负性较大的是 . Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是 , 此离子中含有的化学键类型是 , X﹣Z﹣X的键角109.5°.(填“>”“=”或“<”)(提示:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力).
(4)X与Y形成的化合物Y2X的晶胞如图.其中X离子的配位数为 , 以相距一个X离子最近的所有Y离子为顶点构成的几何体为 . 该化合物与MgO相比,熔点较高的是 . 
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为gcm﹣3 . (只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按化学反应中元素化合价是否发生变化,无机反应可以分为氧化还原反应和非氧化还原反应.这种分类方法与将无机反应按反应形式的不同分为四种基本反应类型是完全不同的分类方式,这二者的关系如图.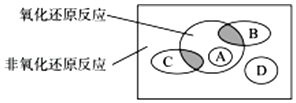
图中方框内区域表示所有的化学反应,大圆内区域表示氧化还原反应,大圆外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:
(1)化学反应可以分为哪四种基本反应类型:、、、 .
(2)若图中B圈表示化合反应,则:
B圈与氧化还原反应重叠的阴影部分表示哪一类反应?;
C圈与氧化还原反应重叠的阴影部分表示哪一类反应?;
请分别举出符合以上两种情况的一个例子:; .
(3)下列说法正确的是 .
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.化学反应中有一种物质被氧化,必定有另外一种物质被还原
D.氧化还原反应发生的本质是化合价发生了变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中有许多有趣的实验,如下介绍的“蓝瓶子”实验就是一例。 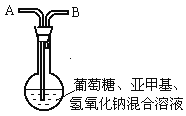
在250 mL平底烧瓶中依次加入2g氢氧化钠、100mL蒸馏水、2g葡萄糖(粉末),振荡使其溶解。滴入4~6滴0.2%的亚甲基蓝溶液,塞上瓶塞(如图),振荡烧瓶,溶液呈蓝色。静置,约3分钟后蓝色消失,变为无色。再次振荡,无色溶液又呈蓝色。可反复多次。为探究是什么原因引起的,有人做了以下实验。
①从烧瓶中取出溶液注满一支试管,塞上橡皮塞。试管中的溶液由蓝色变为无色,再振荡试管溶液不能变蓝。
②在原烧瓶中经A处鼓入空气,又慢慢变蓝了。静置片刻后,蓝色又消失。再次鼓入空气,又慢慢变蓝。
③为了进一步弄清是何种成分引起的,他又继续探索。从A处改通纯净的N2、CO2 , 都不能使烧瓶中的无色溶液变蓝。把制得的氧气从A处通入,发现上述无色溶液慢慢变为蓝色,到此为止,“蓝瓶子”实验原理有了科学结论,请总结“蓝瓶子”实验的变色原理:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(只要成分CaSO4 , 杂质SiO2、Al2O3等)为原料可制备轻质CaCO3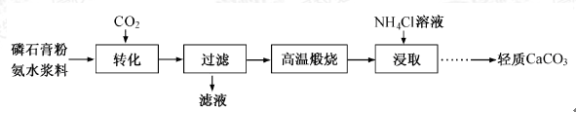
(1)
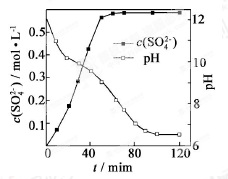
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为 和 (填化学式);检验洗涤是否完全的方法是 。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com