
����Ŀ��Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ġ���֪��ˮ��ȡþ����Ҫ�������£�

(1)���ڼ����Լ������������������¼��ֲ�ͬ������������������⡣
���� | �Ƿ���ȷ | �������� |
����1��ֱ������ˮ�м�������� | ����ȷ | (һ) |
����2�����¼���������ˮ���ټ�������� | (��) | (��) |
����Ϊ����������������ǣ�����������(��) | ||
(һ)__________________________________________________��
(��)__________________________________________________��
(��)__________________________________________________��
(��)__________________________________________________��
(2)��ͼ�м�����Լ���Ӧ����________(�ѧʽ)��������Լ�����________(�ѧʽ)����ҵ������ˮMgCl2��ȡþ�Ļ�ѧ����ʽΪ___________��
���𰸡� ��ˮ��þ����Ũ��С������������������ ����ȷ ��Դ���Ĵ����� ��̲ɹ�κ�õ��Ŀ�±ˮ�У���������� Ca(OH)2 HCl MgCl2(����)![]() Mg��Cl2��
Mg��Cl2��
����������1���Լ���Ӧ��ʯ�����������ķ�Ӧ��MgCl2��Ca(OH)2===Mg(OH)2����CaCl2�����ں�ˮ��þ����Ũ��С������������������������ֱ������ˮ�м���������Ǵ���ģ����¼���������ˮ��Դ���Ĵ����������Ҳ�Ǵ���ģ���2��������þ�����ᷴӦ�õ��Ȼ�þ�������Լ���Ӧ����������Ӧ��Mg(OH)2��2HCl===MgCl2��2H2O��Ȼ��Ũ�����ᾧ����ˮ����ˮMgCl2���ٵ�����ڵ�MgCl2����Ƶ�Mg��MgCl2(����)![]() Mg��Cl2����
Mg��Cl2����


 �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д� ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ڹ������Ƶ������У���ȷ���ǣ� ��
A. ������Na2O2Ͷ����ɫʯ����Һ�У���Һ���ճ���ɫ
B. 1 mol Na2O2��H2O��ȫ��Ӧ��ת��2 mol����
C. ��ּ��ȵ����ʵ�����Na2O2��NaHCO3�Ļ���ʣ������ΪNa2CO3
D. a g CO��H2�Ļ��������ȼ�յIJ�����������Na2O2��ַ�Ӧ������������a g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���� �� ��
A.2molCu��Ħ������64g/molB.2molCu��Ħ������Ϊ128g/mol
C.1molH2SO4������Ϊ98g/molD.����٤�������ĵ�λ��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ�ܵ��磬�����ڷǵ���ʵ���
A. NaOH B. Cl2 C. CO2 D. CH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��Xλ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ�������������Ϊ2��Ԫ��Y��̬ԭ�ӵ�3p�������4�����ӣ�X��Y�γɵĻ�����ľ�����ͼ��ʾ�����й��ڸþ����˵����ȷ���ǣ�������
A.1�����������ӵ�����Ϊ18
B.X2+���ӵ���λ��Ϊ8��Y2�����ӵ���λ��Ϊ4
C.��ÿ��X2+���������X2+����12��
D.�û�����Ļ�ѧʽΪCaS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������ܽ���塢������Һ�����Ƚ϶��Լ�������;����
A. ����ƿ B. �ձ� C. ��Ͳ D. �Թ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������ij�о�С���õ縡ѡ���۷�������ˮ�����װ����ͼ��ʾ������˵����ȷ���ǣ������� 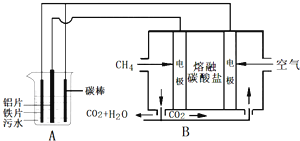
A.װ��A��̼��Ϊ����
B.װ��B��ͨ������ĵ缫��Ӧ��O2+2H2O+4e-�T4OH-
C.��ˮ�м��������������ƣ��ȿ���ǿ��Һ�ĵ����ԣ��ֿ���ǿ���۾�����Ч��
D.��״���£���Aװ���в���44.8L���壬��������Bװ����Ҫ����CH4 11.2L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ���ǣ� ��
A.��ѧ�о�����ҪĿ�ľ�����ʶ����
B.������ѧ���Ž��з����ԭ��ѧ˵��Ϊ������ѧ�ķ�չ�춨�˻���
C.��ѧ�о���������صĻ�����Ⱦ���������ཫ������ڻ�ѧ������
D.��ѧ�ҿ����������Ȼ���в����ڵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ɽ���Ԫ�������γɶ��������磺[Fe��H2NCONH2��6]��NO3��3[�����������غ�������]��Fe��CO��x�ȣ�
�ٻ�̬Fe3+��M������Ų�ʽΪ�� ����
�������Fe��CO��x������ԭ�Ӽ۵������������ṩ������֮��Ϊ18����x= ���� Fe��CO��x�����³�Һ̬���۵�Ϊ��20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�Fe��CO��x�������� ��������ͣ���
��2��O��Na�γɵ�һ��ֻ�������Ӽ������ӻ�����ľ����ṹ��ͼ����һ����������Χ���������������Ϊ���㹹�ɵļ�����Ϊ �� ��֪�þ������ܶ�Ϊ�� g/cm3 �� �����ӵ�����ΪNA �� ���߳�a=�� ��cm�����ú��ѡ�NA�ļ���ʽ��ʾ��
��3�������йص�˵����ȷ���ǡ� ����
A����һ�����ܴ�С��S��P��Si
B���縺��˳��C��N��O��F
C����Ϊ������CaO��KCl�ߣ�����KCl��CaO�۵��
D��SO2��CO2�Ļ�ѧ�������ƣ����ӽṹҲ����ֱ���ͣ���ͬ������SO2���ܽ�ȸ���
E�����Ӿ����У����ۼ�����Խ�÷��Ӿ�����۷е�Խ��
��4��ԭ������С��36��X��Y��Z��W����Ԫ�أ�����X���γɻ�������������Ԫ�أ�Yԭ�ӻ�̬ʱ���������������ڲ��������2����Zԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵĵ��ӣ�W��ԭ������Ϊ29���ش��������⣺
��Y2X2������Yԭ�ӹ�����ӻ�����Ϊ�� �� 1mol Y2X2���ЦҼ�����ĿΪ��
�ڻ�����ZX3�ķе�Ȼ�����YX4�ĸߣ�����Ҫԭ���ǡ� ��
��Ԫ��Y��һ����������Ԫ��Z��һ�������ﻥΪ�ȵ����壬Ԫ��Z������������ķ���ʽ�ǡ� ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com