

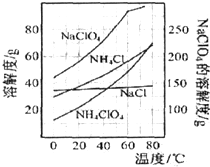
| A、制得粗产品的反应原理为:NH4Cl+NaClO4=NaCl+NH4ClO4↓ |
| B、上述流程中操作Ⅰ为冷却结晶,操作Ⅱ为重结晶 |
| C、洗涤粗产品时,宜用冷水洗涤 |
| D、上述流程中蒸发浓缩时,蒸发至剩余少量溶液时,应停止加热,利用余热将其蒸干,防止晶体飞溅 |


科目:高中化学 来源: 题型:
| A、X和Y两种元素构成一种阴离子,该阴离子与强酸反应时,可能变成Y的阳离子 |
| B、元素Y的最高价氧化物能溶于Z的最高价氧化物的水化物中 |
| C、X、Y和Z三元素组成的化合物为碱 |
| D、X与Z的单质在不同条件下能生成不同的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉溶液、豆浆、雾、碳素墨水均可发生丁达尔现象 |
| B、合金、光导纤维、碳纤维、玻璃钢都属于复合材料 |
| C、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| D、光化学烟雾、臭氧空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 10.4 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 12.4 | 5.2 | 完全溶解:10.8 |
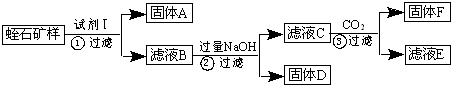
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入0.01 mol?L-1的CH3COOH溶液 |
| B、加入CH3COONa固体 |
| C、稀释 |
| D、加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com