


科目:高中化学 来源: 题型:
| A、在溶液中,导电能力弱的电解质不一定是弱电解质 |
| B、强电解质都是离子化合物,弱电解质都是共价化合物 |
| C、纯净的强电解质在液态时,有的导电,有的不导电 |
| D、虽然SO2的水溶液能导电,但是SO2是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氨水清洗试管内壁附着的银镜 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| D、可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
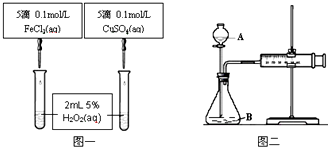
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤⑥ | B、①② |
| C、②③⑤ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

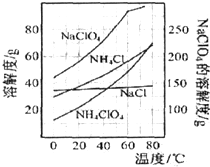
| A、制得粗产品的反应原理为:NH4Cl+NaClO4=NaCl+NH4ClO4↓ |
| B、上述流程中操作Ⅰ为冷却结晶,操作Ⅱ为重结晶 |
| C、洗涤粗产品时,宜用冷水洗涤 |
| D、上述流程中蒸发浓缩时,蒸发至剩余少量溶液时,应停止加热,利用余热将其蒸干,防止晶体飞溅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
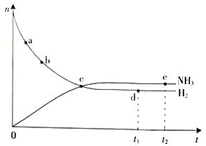 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量时,将NaOH固体直接放在托盘天平的左盘上 |
| B、将NaOH固体在烧杯中溶解后立即转移至容量瓶中 |
| C、定容时,俯视容量瓶的刻度线会使所配溶液的浓度偏高 |
| D、定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com