

 ,故答案为:
,故答案为: ;
;
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
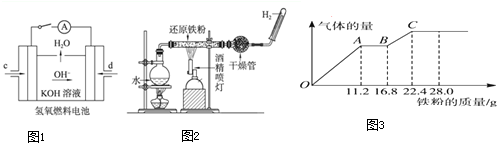
查看答案和解析>>
科目:高中化学 来源: 题型:
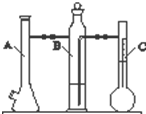 利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.
利用如图所示实验装置可以测定一定条件下1mol气体的体积.图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的稀硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.| 实验 次数 | m(Mg)/g | 硫酸体 积/mL | 液体量瓶中 液体体积/mL | 抽出气体 体积/mL | 氢气体 积/mL | 计算1mol 氢气体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | x | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
| 实验值-理论值 |
| 理论值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
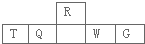
| A、离子半径:T>W |
| B、最高价氧化物对应水化物的酸性:Q>W>G |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物甲溶于水,其水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
| 弱电解质 | HF | CaCO3 | HClO | CH3COONH4 |
| 非电解质 | SO2 | 金属Al | H2O | C2H5OH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

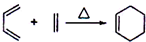 ; ii)CH2=CHCH3
; ii)CH2=CHCH3| Br2 |
| hv |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com