
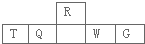
| A、离子半径:T>W |
| B、最高价氧化物对应水化物的酸性:Q>W>G |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物甲溶于水,其水溶液呈中性 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
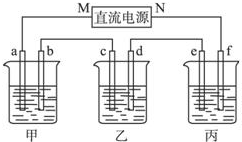 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| △ |
| △ |
| △ |
| △ |
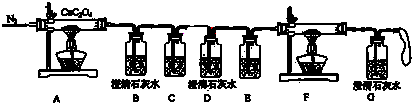
| 操作 | 预期实验现象和结论 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
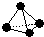 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
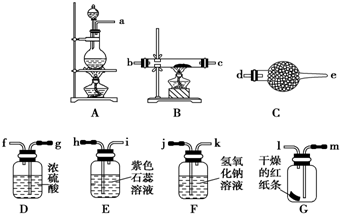
查看答案和解析>>
科目:高中化学 来源: 题型:
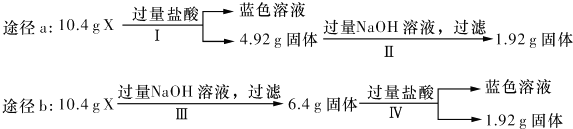
| A、由工可知X中一定存在Fe2 O3、Cu |
| B、无法判断混合物中是否含有Al2O3 |
| C、1.92 g固体成分为Cu |
| D、原混合物中m( Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com