
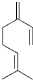
 ,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )
,该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有( )| A、3种 | B、4种 | C、5种 | D、6种 |
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
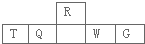
| A、离子半径:T>W |
| B、最高价氧化物对应水化物的酸性:Q>W>G |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物甲溶于水,其水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
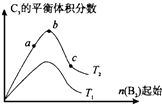 已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol?L-1,放出热量为Q2 kJ.查看答案和解析>>
科目:高中化学 来源: 题型:
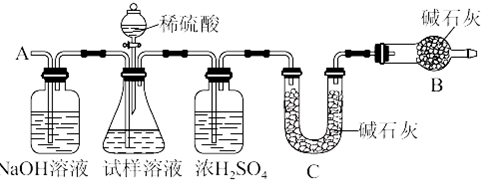
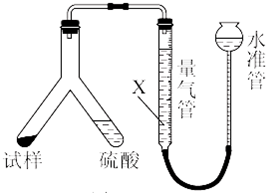
查看答案和解析>>
科目:高中化学 来源: 题型:
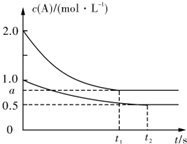 向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:
向甲、乙两恒温恒容的密闭容器中分别充入一定量的A和B,发生反应:| 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1molA 1molB | 0.5molA 0.5molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充人0.2mol A、0.2mol B、0.2mol C,则此时v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com