
【题目】钨(W)在高温下可缓慢升华。碘钨灯中封存的碘蒸气能发生反应:W(s) + I2(g) ![]() WI2(g),利用工作时灯泡壁与灯丝的温度差,将沉积在灯泡壁上的钨“搬运”回灯丝上。对于该过程的理解不正确的是
WI2(g),利用工作时灯泡壁与灯丝的温度差,将沉积在灯泡壁上的钨“搬运”回灯丝上。对于该过程的理解不正确的是
A. 工作时,电能转化为光能和热能
B. 工作时,在灯泡壁和灯丝上发生反应的平衡常数互为倒数
C. W(s) + I2(g) ![]() WI2(g) 为放热反应
WI2(g) 为放热反应
D. 碘蒸气的作用是延长灯丝的使用寿命
【答案】B
【解析】
A、碘钨灯工作时,发光、发热,电能转化为光能和热能,故A正确;
B、工作时,利用灯泡壁与灯丝的温度差,将沉积在灯泡壁上的钨“搬运”回灯丝上,灯丝的温度高于灯泡壁的温度,W在高温下缓慢升华,在灯泡壁上发生反应W(s) + I2(g) ![]() WI2(g),平衡常数K1=
WI2(g),平衡常数K1=![]() 和灯丝上发生反应WI2(g)
和灯丝上发生反应WI2(g) ![]() W(g) + I2(g)的平衡常数K2=
W(g) + I2(g)的平衡常数K2=![]() ,K1 K2不是互为倒数,故B错误;
,K1 K2不是互为倒数,故B错误;
C、利用工作时灯泡壁与灯丝的温度差,将沉积在灯泡壁上的钨“搬运”回灯丝上,灯丝的温度高于灯泡壁的温度,说明升高温度,化学平衡向吸热方向移动,WI2的物质的量减少,所以该反应向逆反应方向移动,即逆反应是吸热反应,所以正反应是放热反应,故C正确;
D、扩散到灯泡壁(低温区)的钨与I2(g)发生反应生成WI2(g),WI2(g)扩散到灯丝(高温区)重新分解出钨沉积到灯丝表面,从而延长钨丝使用寿命,故D正确。
正确答案选B。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是
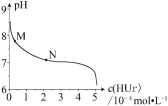
A. 上层清液中,c(Ur-) = 7.0×10-2mol·L-1
B. 在M→N 的变化过程中,c(Na+)·c(Ur-)将逐渐减小
C. 当c(HUr)= c(Ur-)时,c(Cl-)=c(Ur-)
D. 当pH=7时,2c(Na+)= c(Ur-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气无害化处理反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。下列说法正确的是
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
A. 升高温度可使该反应的正反应速率增大,逆反应速率减小
B. 增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染
C. 该反应反应物总能量小于生成物总能量
D. 使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________,往Na2A溶液中加入___________可抑制其水解
A .NaOH固体 B.氯化铁固体 C.水 D.碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为______ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与4mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH>7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________________________________________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为:_____________________(填“V1>V2”“ V1<V2”“ V1=V2”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示。请回答:

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Zn,A极材料为铜,该装置能量转换形式____, A为____极,此电池所发生的反应化学方程式为_____,反应进行一段时间后溶液C中c(H+)将_____(填“变大” “变小”或“基本不变”)。溶液中的SO42-移向____极(填“A”或“B”)
(2)若C为CuSO4溶液,B电极材料为Fe,A极材料为石墨。则B为_____极,B极上电极反应属于____(填“氧化反应”或“还原反应”)。B电极上发生的电极反应式为______,A极产生的现象是_____;若AB两电极质量都为50.0g且反应过程中有0.2mol的电子发生转移,理论上AB两电极质量差为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是

A. 该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B. 该过程中BMO表现较强氧化性
C. 降解产物的分子中只含有极性共价键
D. ①和②中被降解的苯酚的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下事实不能用勒夏特利原理来解释的是: ( )
A. 用排饱和食盐水的方法收集氯气
B. 增大压强,有利于N2和H2反应生成NH3
C. 合成氨工业选择高温(合成氨反应为放热反应)
D. 在Fe3++3SCN - ![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂均过量):
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐。
精盐。
下列叙述正确的是
A.第④发生的反应只有CaCl2+Na2CO3=CaCO3↓+2NaCl
B.③中的试剂可以是NaOH溶液也可以是KOH溶液
C.步骤②和④顺序可以颠倒
D.⑤步操作用到的玻璃仪器只有烧杯、漏斗和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述符合的是

A. 用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C. 图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中![]() 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D. 图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com