
【题目】室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是
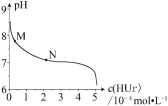
A. 上层清液中,c(Ur-) = 7.0×10-2mol·L-1
B. 在M→N 的变化过程中,c(Na+)·c(Ur-)将逐渐减小
C. 当c(HUr)= c(Ur-)时,c(Cl-)=c(Ur-)
D. 当pH=7时,2c(Na+)= c(Ur-)+c(Cl-)
【答案】B
【解析】
A.尿酸钠(NaUr)悬浊液静置取上层清液,为尿酸钠的饱和溶液,难溶电解质的沉淀溶解方程式为NaUr(s)![]() Na+(aq)+Ur-(aq),
Na+(aq)+Ur-(aq),![]() ,c(Na+)= c(Ur-),则
,c(Na+)= c(Ur-),则![]() ,A项错误;
,A项错误;
B.上层清液中c(Na+)=c(Ur-),存在水解平衡Ur-+H2O![]() HUr+OH-,通入HCl,忽略溶液体积的变化,c(Na+)不变;c(H+)增加,c(Ur-)减小,则c(Na+)·c(Ur-)减小,B项正确;
HUr+OH-,通入HCl,忽略溶液体积的变化,c(Na+)不变;c(H+)增加,c(Ur-)减小,则c(Na+)·c(Ur-)减小,B项正确;
C.HUr的电离方程式为HUr![]() H++Ur-,
H++Ur-,![]() ,当c(HUr)= c(Ur-)时,则
,当c(HUr)= c(Ur-)时,则![]() mol/L >1×10-7mol/L,溶液呈酸性;溶液中电荷守恒为c(Cl-)+c(OH-)+c(Ur-)=c(H+)+c(Na+),物料守恒,c(Na+)=c(HUr)+c(Ur-);联立两式,c(Cl-)+c(OH-)=c(HUr)+c(H+),因溶液呈酸性,c(OH-) <c(H+),则c(Cl-) >c(HUr),c(HUr)= c(Ur-),则c(Cl-) >c(Ur-),C项错误;
mol/L >1×10-7mol/L,溶液呈酸性;溶液中电荷守恒为c(Cl-)+c(OH-)+c(Ur-)=c(H+)+c(Na+),物料守恒,c(Na+)=c(HUr)+c(Ur-);联立两式,c(Cl-)+c(OH-)=c(HUr)+c(H+),因溶液呈酸性,c(OH-) <c(H+),则c(Cl-) >c(HUr),c(HUr)= c(Ur-),则c(Cl-) >c(Ur-),C项错误;
D.溶液中电荷守恒,c(Cl-)+c(OH-)+c(Ur-)=c(H+)+c(Na+),而且pH=7,c(OH-)=c(H+),则c(Cl-)+c(Ur-)= c(Na+),D项错误;
本题答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z 三元素在周期表中的位置如图所示,三元素的原子序数之和是 41。X 和 T 的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U 单质在 Z 单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是 X______,Y______,Z______。
(2)Y 原子的结构示意图为_______。
(3)用电子式表示 Y 与 T 组成的化合物的形成过程:______。
(4)YX2 和 U2Y 反应的化学方程式为______, 其中氧化剂是______,被氧化的元素是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是___________;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25℃时,pH =5的稀醋酸溶液中,由水电离的c(OH-)=____________mol·L-1 ,c(CH3COO-)=_____________mol·L-1 (填数字表达式);
(3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是_______________;

(4)25 ℃时,向体积为Va mLpH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与的Vb关系是Va________________Vb(填“>”、“<”或“=”)。
(5)25 ℃时,若向氨水中加入稀盐酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(Cl-)=________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 2.3g钠在足量的氧气中燃烧,转移的电子数为0.1NA
B. 标准状况下,2.24L Cl2溶于水或NaOH溶液中转移的电子数均为0.1NA
C. 常温常压下,18gH2O含有的氢原子总数为NA
D. 0.1molCH3OH中所含C-H键的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用![]() 、、
、、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
![]()

A.使用催化剂时,合成氨的反应放出的热量减少
B.在该过程中,N2、H2 断键形成 N 原子和 H 原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性联氨燃料电池具有能量密度较高和无污染等特点,其工作原理如下图所示,下列说法不正确的是

A.负极反应:N2H4-4e-=4H++N2↑
B.通入氧气的电极为正极
C.电池工作时OH-向负极移动
D.该电池工作一段时间后,电解质溶液碱性不变(不考虑电解质溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与水反应剧烈;钠与乙醇反应平缓 | 羟基中氢的活泼性:H2O> C2H5OH |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨(W)在高温下可缓慢升华。碘钨灯中封存的碘蒸气能发生反应:W(s) + I2(g) ![]() WI2(g),利用工作时灯泡壁与灯丝的温度差,将沉积在灯泡壁上的钨“搬运”回灯丝上。对于该过程的理解不正确的是
WI2(g),利用工作时灯泡壁与灯丝的温度差,将沉积在灯泡壁上的钨“搬运”回灯丝上。对于该过程的理解不正确的是
A. 工作时,电能转化为光能和热能
B. 工作时,在灯泡壁和灯丝上发生反应的平衡常数互为倒数
C. W(s) + I2(g) ![]() WI2(g) 为放热反应
WI2(g) 为放热反应
D. 碘蒸气的作用是延长灯丝的使用寿命
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com