
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����(����)
A.0.01 mol��L��1��ˮ�У�Cl2��Cl����ClO����������Ŀ֮�ʹ���0.01NA
B.�ڱ�״���£�11.2 L NO��11.2 L O2��Ϻ�����������Ϊ0.75NA
C.0.1 mol Cu�뺬0.2mol H2SO4��Ũ������ȫ��Ӧ����Һ��Cu2����ĿΪ0.1NA
D.2.0 g D2O�к��е�����������������ΪNA
���𰸡�D
��������
A. ��Һ�����֪��������������ȷ������A����
B. ��״���£�11.2 L NO��11.2 L O2��Ӧ����0.5 mol NO2��ʣ��0.25 mol O2����NO2����ƽ�⣺2NO2![]() N2O4�����Ϸ�Ӧ������������������Ϊ0.75NA����B����
N2O4�����Ϸ�Ӧ������������������Ϊ0.75NA����B����
C. ���ᷴӦ������Ũ�Ƚ��ͣ�Cu����ϡ���ᷴӦ������Cu2����ĿС��0.1NA����C����
D. D2O��Ħ������Ϊ20g/mol����2.0 g D2OΪ0.1mol��D2O�����к���2+8=10�����ӣ�10�����ӣ���2.0 g D2O�к��е�����������������ΪNA����D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ�����ҵ�У��̵����������������̵�ұ������ԭ��Ϊ�̿�ʯ����Ҫ�����̿�![]() ����������
����������![]() ��FeO��
��FeO��![]() ��NaCl��ʯ�ҵȣ�
��NaCl��ʯ�ҵȣ�
���������� |
|
|
|
|
|
��ʼ������ ��ȫ��pH |
|
|
|
|
|
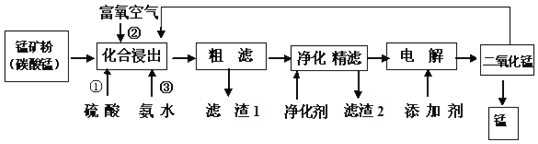
��ش��������⣺
![]() �ڻ��Ͻ����У�Ϊ����߽�������߲�Ʒ���ȣ�ͨ������______
�ڻ��Ͻ����У�Ϊ����߽�������߲�Ʒ���ȣ�ͨ������______![]() ����д���ַ���
����д���ַ���![]()
![]() �ڸù�������������1�ɷֻ�ѧʽΪ______��ͨ�����뾻������Ҫ�ɷ�Ϊ
�ڸù�������������1�ɷֻ�ѧʽΪ______��ͨ�����뾻������Ҫ�ɷ�Ϊ![]() ������2��ѧʽΪ______��
������2��ѧʽΪ______��
![]() ���̺��������º���������ˮ����ҵ��DZˮԱ��Ҫ�����ľ��Ǹ����������������ø��������������������������ɱ����������õĿ�������Ĥ���뷨�Ʊ��ĸ����������÷�����ԭ����______
���̺��������º���������ˮ����ҵ��DZˮԱ��Ҫ�����ľ��Ǹ����������������ø��������������������������ɱ����������õĿ�������Ĥ���뷨�Ʊ��ĸ����������÷�����ԭ����______
![]() д��������ʱ�����ĵ缫��Ӧʽ______��
д��������ʱ�����ĵ缫��Ӧʽ______��
![]() ���ȷ������ķ������ж������̣�������Ϊ���������뻯�Ͻ���������̿�������ʣ������ӷ�Ӧ����ʽ�ǣ�______��
���ȷ������ķ������ж������̣�������Ϊ���������뻯�Ͻ���������̿�������ʣ������ӷ�Ӧ����ʽ�ǣ�______��
![]() �ڵ��Һ��
�ڵ��Һ��![]() ���˹������ڵ������л������Ⱦ�ͨ��Ҫ��ʱ���
���˹������ڵ������л������Ⱦ�ͨ��Ҫ��ʱ���![]() �Ĵ�С��������ʾ
�Ĵ�С��������ʾ![]() ��
��![]() ����
����![]() Ϊש��ɫ��ͨ������
Ϊש��ɫ��ͨ������![]() Ϊ�ζ�������
Ϊ�ζ�������![]() ��ָʾ�����ж����ⶨ
��ָʾ�����ж����ⶨ![]() �Ĵ�С���������ó����ζ��յ�ʱ������______����
�Ĵ�С���������ó����ζ��յ�ʱ������______����![]() ������ȫʱ
������ȫʱ![]() ��ʼ��������ʱ��Һ��
��ʼ��������ʱ��Һ��![]() ______��
______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Licht�ȿ�ѧ����Ƶ�Al��MnO4�����ԭ����ͼ��ʾ������ܷ�ӦΪAl��MnO4��===AlO2����MnO2������˵����ȷ����(�� ��)
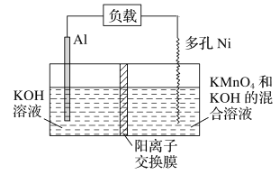
A. ��ع���ʱ��K�������ƶ�
B. Al�缫������ԭ��Ӧ
C. �����ĵ缫��ӦʽΪMnO4����4H����3e��===MnO2��2H2O
D. �����ϵ�·��ÿͨ��1mol���ӣ�����������С9g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ��ʾ����������������ǣ�

A. ������ˮ�ķ�����Ҫ�������������������ӽ�����
B. ��NaClΪԭ�Ͽ��������ռ��������ơ�����������Ȼ�����Ʒ
C. ������й����ȿ��������壬����Ϊ���������ܶȱȿ������ܶ�С
D. ��SO2ˮ��Һ����Br2�����ӷ�Ӧ����ʽΪ��Br2+SO2+2H2O�T4H++SO42��+2Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() þ���Ͻ���뵽
þ���Ͻ���뵽![]() ϡ�����У�ǡ����ȫ��Ӧ���ռ�����ԭ����NO����
ϡ�����У�ǡ����ȫ��Ӧ���ռ�����ԭ����NO����![]() ��״�������跴Ӧ�л�ԭ����ֻ��
��״�������跴Ӧ�л�ԭ����ֻ��![]() ����������Һ�м���
����������Һ�м���![]() ��Һ
��Һ![]() �����������ܽ⣬�����й������������
�����������ܽ⣬�����й������������
A.�Ͻ���Al����������ԼΪ![]()
B.ԭϡ�����Ũ��Ϊ![]()
C.��Ӧ���ղ�������![]()
D.�����������Ļ��Һ�еμ�![]() ϡ���ᣬ�����ij�����ȫ�ܽ�
ϡ���ᣬ�����ij�����ȫ�ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij5L��Һֻ���ܺ���Fe2+��Mg2+��Cu2+��NH4+��Al3+��Cl-��OH-�е�һ�ֻ��֡�������һ�ֵ���ɫ���岢����ʱ���д̼�����ζ����Ͱ�ɫ�������������뵭��ɫ��������ʵ���(������)�����������Ͳ�����������ʵ���(������)�Ĺ�ϵ��ͼ��ʾ���øõ���ɫ��������ɫ��Ӧ������ʻ�ɫ��
��ش���������:
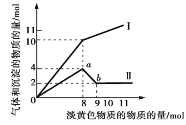
(1)���������������_____(����������������)��
(2)ab�η�����Ӧ�����ӷ���ʽΪ_____________________��
(3)ԭ��Һ������������Ϊ___���������ӷ��ţ�������Ũ��Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ��ķ�ӦΪN2(g)��3H2(g)![]() 2NH3(g)����֪���л�ѧ���ļ��ܣ�
2NH3(g)����֪���л�ѧ���ļ��ܣ�
��ѧ�� | ����kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
����˵����ȷ����
A. �÷�ӦΪ���ȷ�ӦB. �÷�Ӧ�з�Ӧ��������������������������
C. ��Ӧ����H��92 kJ��mol��1D. ����1 mol NH3�ų�92 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ú�﮷���(��Ҫ����Ԫ�صĺ�����Li3.50% Ni 6.55% Ca 6.41% Mg 13.24%)�Ʊ�Li2CO3���������Ʊ�Li+��ص���������LiFePO4�����ֹ����������£�
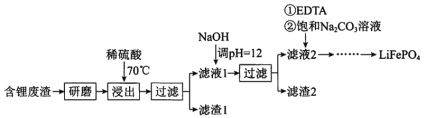
���ϣ�i. ��Һ1����Һ2�в������ӵ�Ũ��(g��L-1)��

ii. EDTA�ܺ�ijЩ���۽��������γ��ȶ���ˮ��������
iii.ijЩ���ʵ��ܽ��(S)��
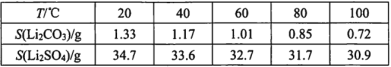
I.�Ʊ�Li2CO3��Ʒ
(1)����2����Ҫ�ɷ���____________��
(2)����Һ2���ȼ���EDTAĿ���ǣ�________���ټ��뱥��Na2CO3��Һ��90���ַ�Ӧ���������Li2CO3��Ʒ�IJ�����________��
(3)����1 kg���3.50%�ķ�����﮵Ľ�����Ϊa, Li+ת��ΪLi2CO3��ת����Ϊb,���Ʒ�к�Li2CO3��������________g��(��a,b��ʾ�軯��Ħ��������Li 7g��mol-1 Li2CO3 74 g��mol-1 )
II.����Li2CO3��Ʒ
(4)��Li2CO3ת��ΪLiHCO3���ø�Ĥ�����LiHCO3��Һ�Ʊ��ߴ��ȵ�LiOH����ת���õ�ؼ�Li2CO3�����ԭ����ͼ��ʾ�������ĵ缫��Ӧʽ��______________���ó�ʹ����________(����������������)���ӽ���Ĥ��

III.�Ʊ�LiFePO4
(5)����ؼ�Li2CO3��C�� FePO4�����·�Ӧ��������2�ֲ���������һ��Ϊ��ȼ�����壬�÷�Ӧ�Ļ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.������ͨʽΪCnH2n+2����nֵ����̼Ԫ�ص������ٷֺ�����С
B.��ϩ����ˮ�����ӳɷ�Ӧ�IJ���Ϊ������
C.1mol��ǡ����3mol������ȫ�ӳɣ�˵��һ����������������̼̼˫��
D.C7H16����������5��̼ԭ�ӵ�ͬ���칹�干��5��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com