
����Ŀ���ú�﮷���(��Ҫ����Ԫ�صĺ�����Li3.50% Ni 6.55% Ca 6.41% Mg 13.24%)�Ʊ�Li2CO3���������Ʊ�Li+��ص���������LiFePO4�����ֹ����������£�
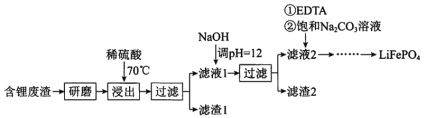
���ϣ�i. ��Һ1����Һ2�в������ӵ�Ũ��(g��L-1)��

ii. EDTA�ܺ�ijЩ���۽��������γ��ȶ���ˮ��������
iii.ijЩ���ʵ��ܽ��(S)��
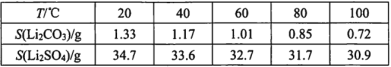
I.�Ʊ�Li2CO3��Ʒ
(1)����2����Ҫ�ɷ���____________��
(2)����Һ2���ȼ���EDTAĿ���ǣ�________���ټ��뱥��Na2CO3��Һ��90���ַ�Ӧ���������Li2CO3��Ʒ�IJ�����________��
(3)����1 kg���3.50%�ķ�����﮵Ľ�����Ϊa, Li+ת��ΪLi2CO3��ת����Ϊb,���Ʒ�к�Li2CO3��������________g��(��a,b��ʾ�軯��Ħ��������Li 7g��mol-1 Li2CO3 74 g��mol-1 )
II.����Li2CO3��Ʒ
(4)��Li2CO3ת��ΪLiHCO3���ø�Ĥ�����LiHCO3��Һ�Ʊ��ߴ��ȵ�LiOH����ת���õ�ؼ�Li2CO3�����ԭ����ͼ��ʾ�������ĵ缫��Ӧʽ��______________���ó�ʹ����________(����������������)���ӽ���Ĥ��

III.�Ʊ�LiFePO4
(5)����ؼ�Li2CO3��C�� FePO4�����·�Ӧ��������2�ֲ���������һ��Ϊ��ȼ�����壬�÷�Ӧ�Ļ�ѧ����ʽ��____________��
���𰸡�Mg(OH)2 ��Ni(OH)2 ��Ca(OH)2 ��ȥ������ ���ȹ��� 185ab 4OH��- 4e- = O2��+2H2O �� LiCO3 + 2C + 2FePO4 = 2LiFePO4 + 3CO��
��������
�������̣�����﮷�����ĥ����70����������ϡ����������еĽ������ӣ��õ����е�Li+��Ni2+��Ca2+��Mg2+������Һ�����в���Ca2+���������������CaSO4���������ˣ�����1��Ҫ��CaSO4������Һ1�м���NaOH����pH=12����Ni2+��Ca2+��Mg2+������2��ҪΪNi��OH��2��Mg��OH��2���м�������Ca��OH��2����Һ2����Li+������Һ2���ȼ���EDTA���ټ��뱥��Na2CO3��Һ��90����ַ�Ӧ�õ����������ȹ��˵õ���ƷLi2CO3����Li2CO3ת��ΪLiHCO3���ø�Ĥ�����LiHCO3��Һ�Ʊ��ߴ��ȵ�LiOH����ת���õ�ؼ�Li2CO3������ؼ�Li2CO3��C��FePO4�����·�Ӧ��Li2CO3+2C+2FePO4=2LiFePO4+3CO�����ݴ˷�������
��1�����ݷ�����Һ1�м���NaOH����pH=12����Ni2+��Ca2+��Mg2+��������2��ҪΪNi��OH��2��Mg��OH��2���м�������Ca��OH��2��
�ʴ�Ϊ��Ni��OH��2��Mg��OH��2��Ca��OH��2��
��2���ڵڶ��ι���֮����Һ�л��в��ָ�����û�г�ȥ��EDTA�ܺ�ijЩ���۽��������γ��ȶ���ˮ�������������ȼ���EDTA���Է�ֹ�����õ���Li2CO3�л���̼��ƣ����ݱ���֪Li2CO3�����ܽ��С����90����ַ�Ӧ��ͨ�����ȹ��˷��������Li2CO3��Ʒ��
�ʴ�Ϊ����ȥ�����ӣ����ȹ��ˣ�
��3��lkg���3.50%�ķ�����﮵Ľ�����Ϊa���������n��Li+��=1000g��3.5%��a/7mol=5amol��Li+ת��ΪLi2CO3��ת����Ϊb�����Ʒ�к�Li2CO3��������5amol��1/2��b��74g/mol=185ab g��
�ʴ�Ϊ��185ab��
��5�����ݵ��ԭ��ͼ������ʧȥ���ӷ���������Ӧ���ŵ�Ϊ���������ӣ��缫��ӦΪ��4OH--4e-=2H2O+O2���������ŵ���������ӣ���������OH-����������õ�LiOH����LiOH���������ɣ�Li+����������Ϊ�����ӽ���Ĥ��
�ʴ�Ϊ��4OH--4e-=2H2O+O2��������
��6��Li2CO3��C��FePO4�����·�Ӧ������LiFePO4��һ�ֿ�ȼ�����壬����Ԫ�ط���������ΪCO����ӦΪ��LiCO3 + 2C + 2FePO4 ![]() 2LiFePO4 + 3CO����
2LiFePO4 + 3CO����
�ʴ�Ϊ��LiCO3 + 2C + 2FePO4 ![]() 2LiFePO4 + 3CO����
2LiFePO4 + 3CO����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���![]() ��Һ�м���
��Һ�м���![]() ��Һ���ɹ۲쵽��������______��������Ӧ�����ӷ���ʽΪ______��������������Һ��pHֵ����Ϊ4������Һ��
��Һ���ɹ۲쵽��������______��������Ӧ�����ӷ���ʽΪ______��������������Һ��pHֵ����Ϊ4������Һ��![]() ����ҺΪ______
����ҺΪ______![]()
![]() ��֪������
��֪������![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����(����)
A.0.01 mol��L��1��ˮ�У�Cl2��Cl����ClO����������Ŀ֮�ʹ���0.01NA
B.�ڱ�״���£�11.2 L NO��11.2 L O2��Ϻ�����������Ϊ0.75NA
C.0.1 mol Cu�뺬0.2mol H2SO4��Ũ������ȫ��Ӧ����Һ��Cu2����ĿΪ0.1NA
D.2.0 g D2O�к��е�����������������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na3OCl��һ�����õ����ӵ��壬���з����ѿ���ṹ���ش��������⣺
��1��CaС��Ti����_______�����ţ���
A������������ B��δ�ɶԵ����� C��ԭ�Ӱ뾶 D������������
��2����O��ClԪ�ؿ���ɲ�ͬ�ĵ��ʺͻ��������Cl2O2���ƻ������㡣
�� Cl2O2�ķе��H2O2�ͣ�ԭ����___________________________________��
�� O3��������ԭ���ӻ�����Ϊ_______��O3�Ǽ��Է��ӣ�������___________________��
��3��Na3OCl�����������ַ����Ƶã�
������ Na2O + NaCl![]() Na3OCl
Na3OCl
����II 2Na + 2NaOH + 2NaCl![]() 2Na3OCl + H2��
2Na3OCl + H2��
�� Na2O�ĵ���ʽΪ____________��
�� �ڷ�����ķ�Ӧ�У��γɵĻ�ѧ����_______�����ţ���
A�������� B�����Ӽ��� C����λ���� D�����Լ� E���Ǽ��Լ�
��4��Na3OCl��������������ϵ���侧���ṹ������ʾ����֪����������Ϊa nm���ܶ�Ϊd g��cm��3��
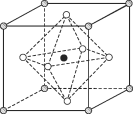
��Na3OCl�����У�Clλ�ڸ�����λ�ã�Naλ��_________λ�ã�����Na֮�����̾���Ϊ________nm��
����a��d��ʾ�����ӵ�������ֵNA=__________________���м���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǽ���þ��±�ص���(X2)��Ӧ�������仯ʾ��ͼ������˵����ȷ����( )
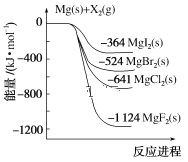
A.��MgCl2��ȡMg�Ƿ��ȹ���
B.���ȶ��ԣ�MgI2��MgBr2��MgCl2��MgF2
C.����þ��±�ص���(X2)�ķ�Ӧ���Ƿ��ȷ�Ӧ
D.��ͼ��֪���¶���MgBr2(s)��Cl2(g)��Ӧ���Ȼ�ѧ����ʽΪMgBr2(s)��Cl2(g)===MgCl2(s)��Br2(g)����H����117 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)������������ȷ����
4NO(g)+6H2O(g)������������ȷ����
A.�ﵽ��ѧƽ��ʱ��4v��(O2)=5v��(NO)
B.����λʱ��������n mol NO��ͬʱ������n mol NH3����Ӧ�ﵽƽ��״̬
C.�ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D.��ѧ��Ӧ���ʹ�ϵ�ǣ�2v��(NH3)=3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L �ܱ������г���2 mol SO2��һ������O2���������з�Ӧ2SO2��O22SO3�����跴Ӧ�������¶Ⱥ㶨������Ӧ���е�4 minʱ�����SO2Ϊ0.4 mol������Ӧ���е�2 minʱ���ܱ�������SO2�����ʵ���Ϊ
A. 1.6 mol B. 1.2 mol C. ����1.6 mol D. ��1.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.100molL��1 NaOH��Һ�ֱ�ζ�20.00mL 0.100molL��1������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ����(����)
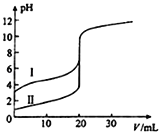
A. ���ʾ���ǵζ����������
B. V(NaOH)=20.00mLʱ��������Һ��c(Cl��)=c(CH3COO��)
C. pH=7ʱ���ζ��������ĵ�V(NaOH)С��20mL
D. V(NaOH)=10.00mLʱ��������Һ��c(Na+)��c(CH3COO��)��c(H+)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�˳�����״��ͭ˿���ھƾ����ϼ��ȣ�ͭ˿�������ɺ�ɫ��___����Ѹ�ٰ�ͭ˿�����ʢ���Ҵ����Թ��У�����ͭ˿����___��������Σ��Թ����д�___��ζ��___���ɣ����漰��Ӧ�Ļ�ѧ����ʽΪ___����Ӧ���Ҵ���___������������������ԭ������ͭ˿��������___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com