
【题目】[化学——选修3:物质结构与性质]
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
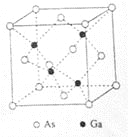
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
【答案】(1)1s22s22p63s23p63d104s24p3(2) 大于 小于 (3)三角锥形 sp3
(4)GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高;
(5)原子晶体;共价键![]()
【解析】
试题分析:(1)As为ⅤA族33号元素,电子排布式为:1s22s22p63s23p63d104s24p3。故答案为:1s22s22p63s23p63d104s24p3;
(2)根据元素周期律,Ga与As位于同一周期,Ga原子序数小于As,故半径Ga大于As,同周期第一电离能从左到右,逐渐增大,故第一电离能Ga小于As。
故答案为:大于;小于;
(3)AsCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,所以原子杂化方式是sp3,由于有一对孤对电子对,分子空间构型为三角锥形。
=4,所以原子杂化方式是sp3,由于有一对孤对电子对,分子空间构型为三角锥形。
故答案为:三角锥形;sp3;
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高。
故答案为:GaF3为离子晶体,GaCl3为分子晶体,离子晶体的熔点高;
(5)GaAs的熔点为1238℃,熔点较高,以共价键结合形成属于原子晶体,密度为ρ gcm-3,根据均摊法计算,As:8×1/8+6×1/2=4,Ga:4×1=4,故其晶胞中原子所占的体积V1=(![]() πr3As×4+
πr3As×4+![]() πr3Ga×4)×10-30,晶胞的体积V2=
πr3Ga×4)×10-30,晶胞的体积V2=![]() =
=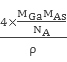 ,故GaAs晶胞中原子的体积占晶胞体积的百分率为
,故GaAs晶胞中原子的体积占晶胞体积的百分率为![]() ×100%将V1、V2带入计算得百分率=
×100%将V1、V2带入计算得百分率=![]() 。
。
故答案为:原子晶体;共价;![]()


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】某同学设计如下实验,证明淀粉水解产物中含有醛基:

(1)试剂X为______________。
(2)试管C中的实验现象为____________________。
(3)写出淀粉在硫酸催化下彻底水解的方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。某同学为了确认其成分,取部分试液,设计并完成了如下实验,由此可知原溶液中
。某同学为了确认其成分,取部分试液,设计并完成了如下实验,由此可知原溶液中![]()
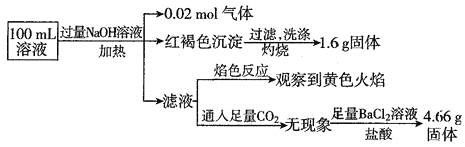
A.原溶液中![]()
B.要确定原溶液中是否含有![]() ,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有
,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有![]()
C.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 、
、![]() 一定不存在
一定不存在
D.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种有机化合物,其结构简式如下,下列有关它的性质叙述中,正确的是( )
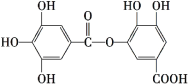
A.酸性条件下 能发生水解反应,水解后能生成两种物质
B.在一定条件下,1 mol该物质最多能与7 mol NaOH完全反应
C.在一定条件下,1 mol该物质可以和8 mol H2发生加成反应
D.有弱酸性,能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
I.岩脑砂的制备
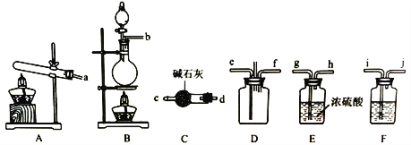
(1)该实验中用浓盐酸与二氧化锰反应制取所需氯气,写出该反应的离子方程式____________
(2)确定上述装置的合理连接顺序:a→____→ef←___(用小写字母和箭头表示,箭头方向与气流方向一致)。
(3)装置F中试剂的作用为___________
(4)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化铵固体可能会堵塞导管,之二为:___________。
II.岩脑砂中元素的测定:准确称取ag岩脑砂,与足量的氧化铜混合加热,利用右图装置测定岩脑砂中氮元素和氯元素的质量之比。充分加热后,G中产生红色固体,H、I装置质量增加,K中收集到无色气体。
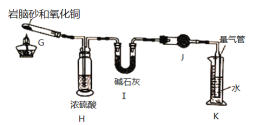
(5)写出G中发生反应的方程式______________________________________________
(6)若没有H装置,会导致测量值_____________(填“偏高”,“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的部分结构模型如图所示:

(1)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的________等气体物质,造成严重的大气污染。
(2)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物3.4-苯并芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。下列物质中适宜作固硫剂的有________(填字母)。
A.氯化钙 B.氧化钙 C.硫酸钙 D.氢氧化钙
(3)某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其“固硫”过程:_____________________________________________________________。
(4)除上述的“型煤”技术外,为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有________、________、________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 石油裂解气可以使溴水褪色,也可以使高锰酸钾溶液褪色
B. 可以用新制的氢氧化铜检验乙醇中是否含有乙醛
C. 正丙醇(CH3CH2CH2OH)和钠反应要比水和钠反应剧烈
D. CH2=CHCH3+Cl2 ![]() CH2=CHCH2 Cl+ HCl属于取代反应
CH2=CHCH2 Cl+ HCl属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 H2O2 和 H2SO4 的混合溶液可溶出废旧印刷电路板上的铜。
已知: Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H= +64.39 kJmol﹣1
2H2O2(l)═2H2O(l)+O2(g)△H=﹣196.46 kJmol﹣1
H2(g)+ 1/2O2(g)═H2O(l))△H=﹣285.84 kJmol﹣1
在 H2SO4 溶液中,Cu 与 H2O2 反应生成 Cu2+(aq)和 H2O(l)的反应热△H 等于( )
A.﹣417.91kJmol﹣1B.﹣319.68 kJmol﹣1
C.+546.69 kJmol﹣1D.﹣448.46 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com