
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。某同学为了确认其成分,取部分试液,设计并完成了如下实验,由此可知原溶液中
。某同学为了确认其成分,取部分试液,设计并完成了如下实验,由此可知原溶液中![]()
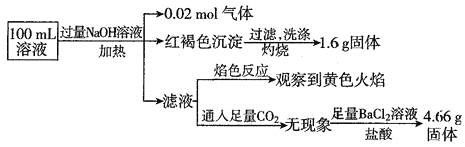
A.原溶液中![]()
B.要确定原溶液中是否含有![]() ,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有
,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有![]()
C.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 、
、![]() 一定不存在
一定不存在
D.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
【答案】D
【解析】
由题给实验现象可知,加入过量NaOH溶液,加热,得到![]() 气体,该气体为氨气,则原溶液中一定存在
气体,该气体为氨气,则原溶液中一定存在![]() ;产生的红褐色沉淀为氢氧化铁,
;产生的红褐色沉淀为氢氧化铁,![]() 固体为氧化铁,氧化铁的物质的量为
固体为氧化铁,氧化铁的物质的量为![]() ,则原溶液中含有
,则原溶液中含有![]() 铁元素,可能为
铁元素,可能为![]() 、
、![]() ,原溶液中一定没有
,原溶液中一定没有![]() ;滤液通入二氧化碳无现象,则原溶液中一定不存在
;滤液通入二氧化碳无现象,则原溶液中一定不存在![]() ;焰色反应为黄色,则溶液中一定存在钠离子,由于实验时加入了NaOH溶液,无法判断原溶液中是否含有
;焰色反应为黄色,则溶液中一定存在钠离子,由于实验时加入了NaOH溶液,无法判断原溶液中是否含有![]() ;
;![]() 不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为
不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为![]() ,则原溶液中含有
,则原溶液中含有![]() 硫酸根离子,据电荷守恒,原溶液中一定有
硫酸根离子,据电荷守恒,原溶液中一定有![]() ,物质的量至少为
,物质的量至少为 ![]() 。
。
A项、根据以上分析可以知道,原溶液中含有![]() 铁元素,无法判断存在的是铁离子或者亚铁离子,故A错误;
铁元素,无法判断存在的是铁离子或者亚铁离子,故A错误;
B项、检验亚铁离子时,取少量原溶液于试管中,加KSCN溶液,此时溶液现象必须是无色,然后再加入适量氯水,溶液呈血红色,则含有![]() ,否则如果加入硫氰化钾溶液后显示红色,则无法证明原溶液中是否含有亚铁离子,故B错误;
,否则如果加入硫氰化钾溶液后显示红色,则无法证明原溶液中是否含有亚铁离子,故B错误;
C项、根据以上分析可以知道,原溶液中一定存在![]() 、
、![]() 、
、![]() ,只是存在
,只是存在![]() 、
、![]() 中的一种,其离子的物质的量为
中的一种,其离子的物质的量为![]() ,一定不存在
,一定不存在![]() 、
、![]() ;因为第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故C错误;
;因为第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故C错误;
D项、根据以上分析,原溶液中一定存在![]()
![]() ,
,![]()
![]() ,
,![]()
![]() 、
、![]() 中的一种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为:
中的一种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为:![]() ,而负电荷的物质的量为:
,而负电荷的物质的量为:![]() ,根据溶液电中性可以知道,原溶液中一定存在
,根据溶液电中性可以知道,原溶液中一定存在![]() ,且
,且![]() ,故D正确;
,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是![]()
A.凡是离子化合物在离子方程式中都要以离子来表示
B.离子互换反应总是向着溶液中离子浓度减小的方向进行
C.酸碱中和反应的实质是![]() 和
和![]() 结合生成水,故酸碱中和反应的离子方程式都是
结合生成水,故酸碱中和反应的离子方程式都是![]()
D.复分解反应必须具备离子反应生成的三个条件才能进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的叙述正确的是( )
A.丙烷的二卤代物是4种,则其六卤代物是2种
B.某烃的同分异构体只能形成一种一氯代物,其分子式一定为C5H12
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.对二甲苯的核磁共振氢谱显示有3种不同化学环境的氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 混合而成,为检验它的成分,做了如下实验:
混合而成,为检验它的成分,做了如下实验:![]() 已知
已知![]() 不能被稀
不能被稀![]() 氧化,
氧化,![]() 微溶于水
微溶于水![]()
![]() 将固体溶于足量水,搅拌后静置,得到无色透明溶液和白色沉淀;
将固体溶于足量水,搅拌后静置,得到无色透明溶液和白色沉淀;
![]() 取等量固体加入足量的稀硝酸中,有刺激性气味黄绿色气体产生,同时有白色沉淀生成。根据以上实验现象,你认为以下判断正确的是
取等量固体加入足量的稀硝酸中,有刺激性气味黄绿色气体产生,同时有白色沉淀生成。根据以上实验现象,你认为以下判断正确的是![]()
![]()
A.一定含有![]() 、
、![]() 、
、![]()
B.无法判断是否含有![]()
C.一定含有![]() 、
、![]() 、
、![]() ,不能肯定是否含有
,不能肯定是否含有![]()
D.是否含![]() ,只要把实验
,只要把实验![]() 产生的气体通入少量澄清石灰水中,若没有变浑浊,则一定不含
产生的气体通入少量澄清石灰水中,若没有变浑浊,则一定不含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法不正确的是
A.苯与浓硝酸、浓硫酸共热并保持![]() 反应生成硝基苯
反应生成硝基苯
B.用![]() 与
与![]() 发生酯化反应,生成的有机物为
发生酯化反应,生成的有机物为![]()
C.苯乙烯在合适条件下催化加氢可生成乙基环己烷
D.戊烷![]() 的一溴取代物共有8种
的一溴取代物共有8种![]() 不含立体异构
不含立体异构![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,CH3COOH的电离平衡常数Ka=1.75×10-5,NH3·H2O的电离平衡常数Kb=1.75×10-5,现在25 ℃时向10 mL浓度均为0.1 mol·L-1的HCl和CH3COOH的混合溶液中逐滴加入0.1 mol·L-1的氨水,溶液的pH变化曲线如图所示。下列有关说法不正确的是( )
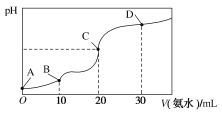
A.A点到B点,溶液的导电性逐渐减小
B.整个过程中,C点处水的电离程度最大
C.pH =7时对应的点应在C点和D点之间,此时溶液中存在:c(NH4+)=c(CH3COO-)+c(CH3COOH)
D.D点处:c(NH4+)>c(Cl-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物溶于水,所得溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子,且各种离子的物质的量相同。为了确定其组成,进行如下实验:
中的几种离子,且各种离子的物质的量相同。为了确定其组成,进行如下实验:
(1)取一定量的样品,加足量水充分溶解,得到澄清溶液。
(2)取少量溶液,滴入足量稀硝酸,再滴入足量硝酸钡溶液,有沉淀生成;充分振荡,静置,向上层清液中滴入硝酸银溶液,有沉淀生成。
(3)再取少量![]() 中溶液,加入氢氧化钠溶液,有沉淀生成。
中溶液,加入氢氧化钠溶液,有沉淀生成。
根据上述实验现象,该固体样品的成分可能是
A.该混合物一定是NaCl和![]()
B.该混合物一定是NaCl和![]()
C.该混合物可能是![]() 和
和![]()
D.该混合物可能是![]() 和
和![]() 3
3
查看答案和解析>>
科目:高中化学 来源: 题型:
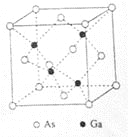
【题目】[化学——选修3:物质结构与性质]
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是

A. X、Y为曲线两交叉点。由X点处的pH,可计Ka1(H2S)
B. Y点对应溶液中c(Na+)与含硫各微粒浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C. X、Y点对应溶液中水的电离程度大小关系为:X > Y
D. 已知NaHS呈碱性,若向溶液中加入CuSO4溶液至恰好完全反应,所得溶液呈强酸性。其原因是Cu2++HS-=CuS↓+H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com