
【题目】图甲是一种利用微生物将废水中的尿素CO(NH2)2]转化为环境友好物质的原电也装置示意图,利用该电池在图乙装置中的铁上镀铜。下列说法正确的是
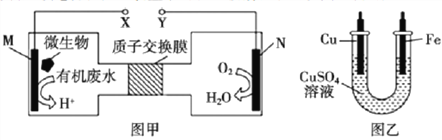
A. 图乙中Fe电极应与图甲中Y相连接
B. 图甲中H+透过质子交护膜由右向左移动
C. 图甲中M电极反应式:CO(NH2)2+5H2O-14e=CO2+2NO2+14H+
D. 当图甲中M电极消耗0.5mol尿素时,图乙中铁电极增重96g
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂.医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液.已知:某温度下,Ksp(BaCO3)=5.1×10﹣9 mol2L﹣2;Ksp(BaSO4)=1.1×10﹣10 mol2L﹣2下列推断正确的是( )
A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C.若误饮c(Ba2+)=1.0×10﹣5 molL﹣1的溶液时,会引起钡离子中毒
D.可以用0.36 molL﹣1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.50molL﹣1NaOH标准液10.00mL,将未知浓度的盐酸20.00mL恰好滴定至终点,下列说法正确的是( )
A.若选用酚酞作指示剂,终点时,液体恰好褪色
B.用量筒量取上述盐酸
C.若滴定完毕,滴定管尖嘴悬有一滴液体,则所测的盐酸浓度偏大
D.盐酸的浓度为1.00 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某兴趣学习小组设计如图装置制取SO2,研究其性质。
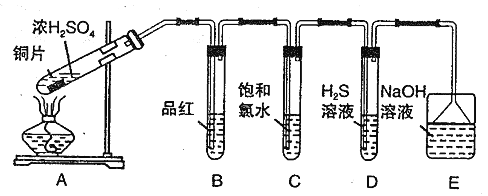
请回答下列问题:
(1)B、C、D分别用于检验SO2 的性质,写出C中反应的离子方程式_______。
(2)实验中观察到D 中有浑浊出现,有同学提出此现象不能证明SO2 具有氧化性,请简述理由________________________。
(3)E装置的作用为______________。
II.某学习小组进一步探究不同浓度的硫酸氧化性不同,设计并完成如下实验:
称取一定量还原铁粉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y 中含有SO2、H2。
(4)溶液X中含有的金属阳离子是(填化学式)_________,简述如何检验该离子______。
(5)为了测定气体Y 中SO2 的含量,将2.24 L( 标准状况)气体Y 通入到200.00mL0.2000mol/L 酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗0.1000mol/L的KHC2O4标准液10.00mL (高锰酸钾被还原均生成Mn2+ )。
①已知室温下,0.1000mol/L KHC2O4 的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作过程中标准液应用_______(填仪器名称)盛装;滴定终点的现象为____________。
②计算气体Y 中SO2 的物质的量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb还含有少量的Ag、CaO) 可制备硫酸铅。制备流程图如下:

已知: Ksp(PbSO4)=1.6×10-8Ksp(CaSO4)=4.9×10-5
(1)步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+,写出Pb参加反应的化学方程式__________________,为防止Ag被溶解进入溶液,步骤I操作时应注意____________。
(2)粗PbSO4产品含有的杂质是________;要得到纯净的PbSO4,需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是__________________。
A.稀硫酸 B.稀盐酸 C.硝酸铅溶液 D.酒精
(3)母液可循环利用的物质是HNO3,若母液中残留的SO42-过多,循环利用时可能出现的问题是_____________________。
(4)若将步骤II中的Pb2+完全沉淀,则溶液中的c(SO42-)至少为_____mol/L。
(5)(CH3COO)2Pb是皮毛行业的染色助剂,可用PbSO4 与CH3COONH4反应制备,写出反应的离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的相差4 |
F 是前四周期原子电子排布图中单电子数最多的元素 |
G在周期表的第十一列 |
(1)B基态原子的电子排布式为;F基态原子的价电子排布式为;G基态原子的最外层电子排布图为 .
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是(用元素符号填空).
(3)B、D的电负性相对大小:BD(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有种,位于p区的有种.
(5)DE3的电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
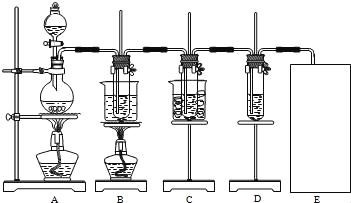
图中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里盛有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过_____(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式是_____.
(2)制取氯酸钾是在装置B中进行的,装置B中制取氯酸钾的化学反应方程式是____________.该小组同学发现制得的氯酸钾产量偏低,原因是氯气中含有杂质,改进方法是______.
(3)实验中装置D的试管中产生的现象是________.
(4)请在装置图方框中画出上述实验还缺少的装置,并注明试剂.________
(5)该小组同学认为:SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.但是如果将SO2和Cl2同时通入到品红溶液中,则会发现褪色效果并不像该小组同学想象的那样.请你分析原因(用离子方程式表示)_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com