
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。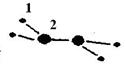
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) | 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
(1) (2分) (2)HSO3—+ Cl2 +H2O = 3H+ + SO42—+ 2Cl- (3分)
(2分) (2)HSO3—+ Cl2 +H2O = 3H+ + SO42—+ 2Cl- (3分)
(3)2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol (3分)
(4) (2分);从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2]。等合理答案均可] (2分)
(2分);从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2]。等合理答案均可] (2分)
(5)① ClO— 对反应速率的影响 (2分)
② 7.2 × 10—4 (2分)
解析试题分析:(1)根据题意推断,M为N2H4,则1、2分别表示H、N,氮原子的核电荷数为+7,核外电子层结构为25;(2)亚硫酸盐与氯水发生氧化还原反应,生成强酸,反应式为HSO3—+Cl2+H2O=3H++SO42—+2Cl-;(3)读表可知,升高温度,平衡右移,说明正反应是吸热反应;根据原子守恒可知,1/2N2(g)+3/2H2O(l) NH3(g)+3/4O2(g) △H=+382.5kJ/mol,或2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol;(4)固体物质不能写进平衡常数表达式,则该反应的平衡常数K=
NH3(g)+3/4O2(g) △H=+382.5kJ/mol,或2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol;(4)固体物质不能写进平衡常数表达式,则该反应的平衡常数K= ;从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2];(5)根据控制变量设计对比实验原则,实验1和2的目的是探究I—的浓度对反应速率的影响,实验2和4的目的是探究ClO—的浓度对反应速率的影响;由实验1和3可知,OH—的浓度对速率无影响,则实验4改编pH后反应速率与实验4相等,即v="7.2" × 10—4。
;从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2];(5)根据控制变量设计对比实验原则,实验1和2的目的是探究I—的浓度对反应速率的影响,实验2和4的目的是探究ClO—的浓度对反应速率的影响;由实验1和3可知,OH—的浓度对速率无影响,则实验4改编pH后反应速率与实验4相等,即v="7.2" × 10—4。
考点:考查物质结构、氧化还原反应、离子方程式、热化学方程式的书写、化学平衡常数的表达式及应用、沉淀的生成、化学反应速率及其影响因素、探究实验方案设计等相关知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
某工厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红(Fe2O3)和氧化铜。(已知铜能溶解在稀硝酸中生成硝酸铜溶液)
请填写下面空白:
(1)图中标号处需加入的相应物质分别是(填化学式)① ②
③ ④ ;
(2)A处固体成分为 (填化学式)
(3)写出⑤处反应的化学方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知: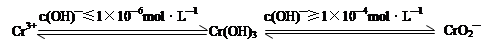
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式 。
②完成用离子方程式表示溶液pH不能超过10(即c(OH)—≥1×10—4mol·L—1)的原因为Cr(OH)3 + OH-= +2H2O。
(2)在硝酸工业生产吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5% NO、1.5% NO2)用纯碱溶液完全吸收,完成反应方程式:NO+3NO2+2Na2CO3=3NaNO2+NaNO3+2 ,该反应中能用纯碱代替氢氧化钠溶液发生反应的原因是利用了Na2CO3水解呈现的 性。
(3)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量?随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,完成有关反应的离子方程式为:
___________+3OH-=Al(OH)3↓+2F-;__________+3OH-=Al(OH)3↓+3F-。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法,
该法的工艺流程为:CrO42-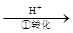 Cr2O72-
Cr2O72-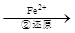 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显________色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要 mol的FeSO4·7H2O。
写出第②步中反应的离子方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2DZ Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式:_____________________。萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是___________________________。
(2)如图是用双硫腙(HzDz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~ CCl4络合萃取法处理废水。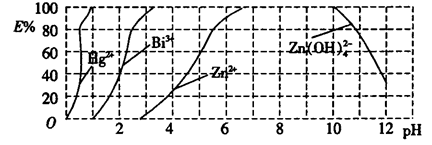
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH=________。
②当调节pH=2时,铋(Bi)的存在形式有_________________。
(3)污水中的亚汞离子(Hg2+ 2)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化(Hg2+ 2),写出该反应的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
仿照电极方程式的书写,我们可以把一些氧化还原反应分成“氧化反应”和“还原反应”两个“半反应”,如Fe+2H+=Fe2++H2↑可分成氧化反应:Fe-2e-= Fe2+还原反应:2H++2e-= H2↑则下列正确的是( )
①Fe+2Fe3+=3Fe2+可分成 氧化反应:Fe-2e-= Fe2+ 还原反应:2 Fe3+ + 2e-=2 Fe2+
②MnO2+2Cl-+4H+=Mn2++Cl2↑+2H2O可分为
氧化反应:2Cl--2e-=Cl2↑ 还原反应:MnO2+2e-+4H+=Mn2++2H2O
③Cl2+H2S=S↓+2H++2Cl- 氧化反应:H2S- 2e-=S↓+ 2H+ 还原反应:Cl2+ 2e-=2Cl-
| A.③ | B.②③ | C.①② | D.①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com