
下列物质属于电解质的是 ;能导电的物质是 。
①氨水 ②蔗糖 ③烧碱 ④NH3·H2O ⑤CO2 ⑥铜
科目:高中化学 来源: 题型:填空题
某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2—、CO32—、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 (3分)
(2)沉淀丙中一定含有 (1分),可能含有 (1分)
(3)该溶液中肯定存在的离子有
(4)气体乙分子的结构式为
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为 ; ; (根据需要,可不填完,也可补充)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有以下物质:①KCI晶体②食盐水③液态的醋酸④I2⑤BaSO4固体⑥蔗糖(C12H22O11 )⑦酒精(C2H5OH)⑧熔融的NaOH⑨K2O⑩SO2。请回答下列问题:
(1)以上物质中能导电的是_________________(用序号)。
(2)以上物质属于电解质的是_________________(用序号)。
(3)以上物质中属于非电解质的是_________________(用序号)。
(4)从②溶液中得到氯化钠固体,应选择下列装置中的______________(填代表装置图的字母,下同);分离④与⑦的混合液,应选择下列装置中的________________。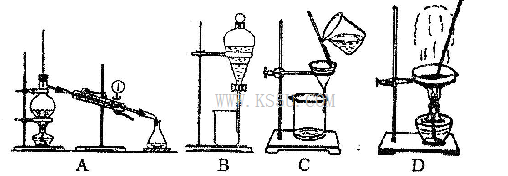
(5)请写出③和⑧中两种物质的溶液混合后发生反应的离子方程式:________________________________________________________________________.
(6)在标准状况下,__________L⑩与34. 2g⑥中含有相同的氧原子数。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: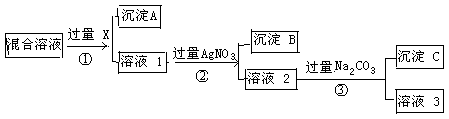
请回答下列问题:⑴写出实验流程中下列物质的化学式
试剂X : 沉淀A:
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。
(4)请写出①②中反应的离子方程式①
②
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有下列物质①NaCl晶体②冰醋酸(纯醋酸晶体) ③干冰 ④铜⑤蔗糖 ⑥熔融的KNO3 ⑦稀硫酸溶液 ⑧酒精 ⑨液氯⑩BaSO4固体
(1)以上物质能导电的是 ;(2)以上物质属于电解质的是 ;(3)以上物质属于非电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
(1)原溶液中是否有SiO32-? (填“有”或“没有”),判断理由是 。(用离子方程式表示)
(2)生成的气体中一定有 。它具有的性质是 (填字母序号)。
| A.无色无味 |
| B.无色有刺激性气味 |
| C.属于大气污染物 |
| D.难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。 
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2+6H2O ="4" Al(OH)3。电池正极的电极反应式是 ;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s)△H = -2830 kJ/mol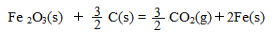 △H = +230 kJ/mol
△H = +230 kJ/mol
C(s)+O2(g) = CO2(g) △H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是 ,铝热反应属于______(填字母)反应。
a.氧化还原 b.复分解 c.置换
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。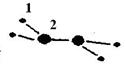
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) | 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
| A.2Na218O2 + 2H2O ="=" 4Nal8OH + O2↑ |
| B.NaH+D2O===NaOH+D2↑ |
| C.2KMnO4 + 5H218O2 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 518O2↑+ 8H2O |
| D.K37ClO3 + 6HCl ="=" K37Cl + 3Cl2↑+ 3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com