
现有下列物质①NaCl晶体②冰醋酸(纯醋酸晶体) ③干冰 ④铜⑤蔗糖 ⑥熔融的KNO3 ⑦稀硫酸溶液 ⑧酒精 ⑨液氯⑩BaSO4固体
(1)以上物质能导电的是 ;(2)以上物质属于电解质的是 ;(3)以上物质属于非电解质的是 。
(1)④⑥⑦ (2) ①②⑥⑩ (3) ③⑤⑧
解析试题分析:①NaCl晶体是化合物,不导电,但在熔融状态下和水溶液中都能导电,属于电解质;
②冰醋酸是化合物,不导电,但溶于水时可导电,属于电解质;
③干冰是化合物,固态和熔融状态下也不导电,溶于水能导电但本身不能电离,属于非电解质;
④铜是单质,能导电,但不是电解质也不是非电解质;
⑤蔗糖是化合物,熔融状态和水溶液中都不导电;属于非电解质;
⑥熔融的KNO3能导电,且是化合物,属于电解质;
⑦稀硫酸溶液能导电,但属于混合物,既不是电解质也不是非电解质;
⑧酒精是化合物,不导电,其水溶液也不导电,属于非电解质;
⑨液氯是单质,不导电,既不是电解质也不是非电解质;
⑩BaSO4固体是化合物,其水溶液不导电,但熔融状态能导电,属于电解质。
考点:考查电解质与非电解质的概念及物质的导电性。


科目:高中化学 来源: 题型:填空题
现有下列物质:①NaCl晶体;②液态SO2;③纯醋酸;④硫酸钡 ;⑤铜;⑥酒精(C2H5OH);⑦熔化的KCl;⑧NaOH溶液。
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按图的装置连接好仪器,先在烧杯中加入20mL左右的Ba(OH)2溶液,接通电源后,逐渐滴加稀硫酸至过量。
(1)当逐渐滴加稀硫酸时,烧杯中观察到的现象是: 。
(2)灯泡的现象是: ;原因是: 。
(3)发生反应的离子方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有M、N两种溶液,经测定这两种溶液中含有下列12种离子:Al3+、Cl-、Na+、K+、NO3-、OH-、Fe2+、AlO2-、CO32-、NH4+、SO42-、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
| 实验内容以及现象 | 结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 | N中不含 离子 |
| ② | 确定M溶液中含有Na+,不含K+ |
 ③用pH试纸检测M溶液,pH试纸呈蓝色 ③用pH试纸检测M溶液,pH试纸呈蓝色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求完成下列填空
(l)写出下列物质的电离方程式:
Fe2(SO4)3__________________________________________________,
NaHCO3______________________________________________________。
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应____________________________________________,
氢氧化钡溶液与稀硫酸反应_______________________________________。
(3)写出与下列离子方程式相对应的化学方程式:
H++OH-=H2O __________________________________________,
CO32-+2H+=CO2↑+H2O__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲容器中发生了某化学反应,测得反应过程中,容器中存在Na+、H2O、CN-、ClO-、HCO3-、N2、Cl-七种粒子,其中ClO-和N2的物质的量随时间变化的曲线如图所示。根据题意完成下列填空: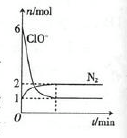
(1)CN一中氮元素的化合价是 。
(2)甲容器中发生反应的离子方程式是 。该反应的氧化产物是 (填化学式)。
(3)乙容器中用ClO2代替ClO-,溶液呈碱性,若最终两容器中N2的物质的量相同。则甲、乙两容器中参加反应的氧化剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法,
该法的工艺流程为:CrO42-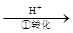 Cr2O72-
Cr2O72-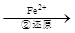 Cr3+
Cr3+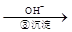 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+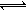 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显________色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要 mol的FeSO4·7H2O。
写出第②步中反应的离子方程式_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=IO3-+5I-+3H2O;KI+I2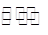 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液后显红色,该红色物质是_____________(用化学式表示);CCl4中显紫红色的物质是___________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为_______________________________________、__________________________________________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?___________ (填“是”或“否”),并说明理由_________________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com