
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.1.6g-NH2和1.5g-CH3含有的电子数均为NA
B.44 g CO2和N2O的混合物中含有的氧原子数为1. 5NA
C.精炼铜,若阳极失去2NA个电子,则阴极增重64 g
D.60 g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C—O键数目为NA
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.2.8g14N2与14C16O的混合物中,中子数目为 l.4NA
B.含 0. l molFeCl3的溶液与0. l mol 锌充分反应,转移电子数为0.l NA
C.标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D.某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
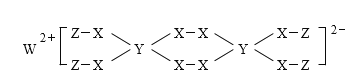
A.工业上通过电解熔融的WX来制得W
B.W、X对应的简单离子半径顺序为:W>X
C.该漂白剂中各元素均满足8电子稳定结构
D.Y的最高价氧化物对应水化物为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以菱镁矿(主要成分为MgCO3含少量FeCO3)为原料制备金属镁的实验流程如下:
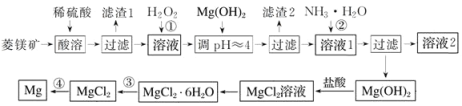
已知:一些金属离转化为氢氧化物沉淀时溶液的pH如表所示
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)上述流程中H2O2的作用是:_____________
(2)滤渣2的主要成分为:_______________;溶液2中的主要溶质为:__________________。
(3)通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,为保证Mg2+沉淀完全,过程②中控制溶液的pH至少为__________________(保留小数点后一位)(已知Mg(OH)2的Ksp=2×10-11,lg2=0.3)
(4)已知MgCl2·6H2O受热时发生水解:MgCl2·6H2O=Mg(OH)Cl+HCl↑+H2O,过程③应该如何操作才能得到无水MgCl2__________________
(5)写出过程④中发生反应的化学方程式:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B.常温下,1L pH=10的氨水溶液中,发生电离的水分子数为1×10-10NA
C.电解精炼铜时,阴极增重3.2g,电路中转移电子数为0.05NA
D.将0.1mol O2与0.2mol NO在密闭容器中充分反应,反应后容器内分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
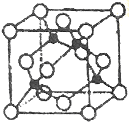
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,71gCl2溶于足量水,所得溶液中Cl2、HClO和ClO-三种微粒总数为NA
B.pH=2的CH3COOH溶液中,H+的数目为0.01NA
C.将5.6g铁块投入一定量的稀硝酸中,恰好完全反应,一定转移0.3NA个电子
D.用电解法精炼铜时,若电路中转移2mol电子,阳极质量减轻64g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com