
| 1 |
| 4 |
| 1 |
| 4 |
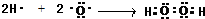 ,在微电子工业中,氨气的水溶液可用作刻蚀剂H2O2的清除剂,反应产物不污染环境,应生成氮气与水,其化学方程式为:2NH3.H2O+3H2O2=N2+8H2O,
,在微电子工业中,氨气的水溶液可用作刻蚀剂H2O2的清除剂,反应产物不污染环境,应生成氮气与水,其化学方程式为:2NH3.H2O+3H2O2=N2+8H2O,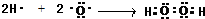 ;2NH3.H2O+3H2O2=N2+8H2O;
;2NH3.H2O+3H2O2=N2+8H2O;

科目:高中化学 来源: 题型:
 ③
③
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
23 11 |
24 12 |
7 3 |
14 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.59 | 0.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
| A、氢化物稳定性的强弱:b>d |
| B、金属性的强弱:f<g |
| C、元素e的氧化物只能与酸反应 |
| D、元素a与元素d形成的化合物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学小组构想将汽车尾气(NO、NO2)转化为重要化工原料HNO3,其原理如示意图,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要化工原料HNO3,其原理如示意图,其中A、B为多孔材料.下列说法正确的是( )| A、电解质溶液中电流方向由B到A,电子流向与之相反 |
| B、电极A表面反应之一:NO-3e-+2H2O=NO3-+4H+ |
| C、电极B附近c(NO3-)增大 |
| D、该电池工作时,每转移4mole一消耗22.4 L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在25℃时,次氯酸的电离方程式及热效应可表示为:HClO(aq)═H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ?mol-1 |
| B、将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后的溶液,一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) |
| C、已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO═HSO3-+ClO- |
| D、已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com