
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A: 4HCl+O2  2Cl2+2H2O。
2Cl2+2H2O。
(1)已知:i 反应A中, 4mol HCI被氧化,放出115.6kJ的热量。
ii
①H2O的电子式是_______________.
②反应A的热化学方程式是____________________________________________________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),

分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是__________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度高低与投料比多少的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数__________。
(1)①H:O:H ②4HCl(g)+O2(g) 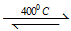 2Cl2+2H2O(g) △H=-115.6kJ/mul ③32或31.9kJ 强
2Cl2+2H2O(g) △H=-115.6kJ/mul ③32或31.9kJ 强
(2)①4:1 ②投料比越小时对应的温度越低 ③30.8%
【解析】
试题解析:(1)①水是含有极性键的共价化合物,所以电子式是H2O的电子式是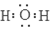 。②4mol HCI被氧化,放出115.6kJ的热量,所以该反应的热化学方程式是4HCl+O2
。②4mol HCI被氧化,放出115.6kJ的热量,所以该反应的热化学方程式是4HCl+O2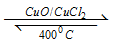 2Cl2+2H2O △H=-115.6kJ/mul; ③1 mol H—O 与1 mol H—Cl的键能分别是设为x和y。因为反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以有4x+498kJ/mol-2×243KJ/mol-2×2×y=-115.6kJ/mol,解得x-y=32 kJ/mol,所以H2O中H—O 键比HCl中H—Cl键强。(2)①氧气的物质的量越多,则氯化氢的转化率越高,即n(HCl):n(O2)的比值越小,氯化氢的转化率越高,所以投料比分别为1:1、2:1、4:1、6:1时氯化氢的转化率一次降低,曲线b对应的投料比是4:1;②根据曲线可知,投料比越小时对应的温度越低。③根据曲线可知投料比为2:1、温度为400℃时,氯化氢的平衡转化率是80% ,
2Cl2+2H2O △H=-115.6kJ/mul; ③1 mol H—O 与1 mol H—Cl的键能分别是设为x和y。因为反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以有4x+498kJ/mol-2×243KJ/mol-2×2×y=-115.6kJ/mol,解得x-y=32 kJ/mol,所以H2O中H—O 键比HCl中H—Cl键强。(2)①氧气的物质的量越多,则氯化氢的转化率越高,即n(HCl):n(O2)的比值越小,氯化氢的转化率越高,所以投料比分别为1:1、2:1、4:1、6:1时氯化氢的转化率一次降低,曲线b对应的投料比是4:1;②根据曲线可知,投料比越小时对应的温度越低。③根据曲线可知投料比为2:1、温度为400℃时,氯化氢的平衡转化率是80% ,
4HCl+O2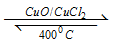 2Cl2+2H2O
2Cl2+2H2O
起始量(mol) 2 1 0 0
转化量(mol) 1.6 0.4 0.8 0.8
平衡量(mol) 0.4 0.6 0.8 0.8
所以平衡混合气中Cl2的物质的量分数是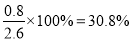 。
。
考点:热化学方程式、外界条件对平衡状态的影响以及可逆反应的有关计算


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:推断题
A~F六种有机物的相互转化关系如图所示:
已知:
据此回答下列问题:
(1)A是合成天然橡胶的单体,用系统命名法命名,A的名称为 ,天然橡胶的结构简式为 。
(2)A生成 时,A发生的反应类型为 。
时,A发生的反应类型为 。
(3) E→F的化学方程式为 。
(4)A与Br2按物质的量比1:1发生加成反应,生成的产物有____种(考虑顺反异构)。
(5)现有另一种有机物G,已知G与E无论按何种比例混合,只要总质量一定,完全燃烧时生成的CO2、H2O以及消耗的O2均为定值。请写出两种符合下列要求的G的结构简式____、 。
① ;
;
②G的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1:3。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二上第一次月考化学试卷(解析版) 题型:选择题
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)  H2(g)+I2(g)的化学平衡常数为( )
H2(g)+I2(g)的化学平衡常数为( )
A.50 B.0.02 C.100 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期第一次月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L NH3所含的原子数为2NA
B.常温常压下,80g SO3含有的氧原子数为3NA
C.标准状况下,22.4L H2中所含原子数为NA
D.一定条件下,56g铁粉与足量的Cl2完全反应转移电子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验中均需要的仪器是( )
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A.试管 B.胶头滴管
C.玻璃棒 D.漏斗
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二第一学期期中考试化学试卷(解析版) 题型:填空题
(1)已知在K2Cr2O7的溶液中存在如下平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为__________;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为__________。
2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为__________;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为__________。
(2)已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是__________(填序号)。
①生成物的产量一定增加
②生成物的体积分数一定增加
③反应物的浓度一定降低
④反应物的转化率一定增加
⑤正反应速率一定大于逆反应速率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二第一学期期中考试化学试卷(解析版) 题型:选择题
已知1 g H2完全燃烧生成水蒸气放出热量121 kJ,且O2中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收的热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高二第一学期期中考试化学试卷(解析版) 题型:选择题
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.只有在催化剂存在条件下,才会发生化学反应速率变化而化学平衡不移动的情况
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高一上学期期中考试化学试卷(解析版) 题型:选择题
现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为 ( )
A.1∶1∶1 B.1∶2∶3 C.3∶2∶1 D.6∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com