
【题目】一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是
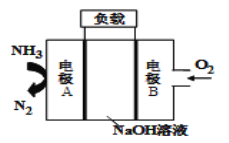
A. 电子由电极A经外电路流向电极B
B. 该电池工作时,每消耗22.4L NH3转移3mol电子
C. 电池工作时,OH-向电极B移动
D. 电极B上发生的电极反应为:O2+ 4H++ 4e-=2H2O
【答案】A
【解析】
本题主要考查化学电源新型电池。液氨-液氧燃料电池中,负极上发生失电子的氧化反应,即A是负极,B是正极,碱性条件下,氧气在正极生成氢氧根离子,燃料电池的总反应是燃料燃烧的化学方程式:4NH3+3O2===2N2+6H2O,电子从负极经导线流向正极,据原电池的工作原理来回答。
A.电子从负极流向正极,即从电极A经外电路流向电极B,正确;
B.燃料电池的总反应是燃料燃烧的化学方程式:4NH3+3O2===2N2+6H2O,该电池工作时,每消耗标准状况下的22.4L即1molNH3转移3mol电子,但题干并未说明是否为标准状况,无法判断NH3的物质的量,错误;
C.原电池中,阴离子向负极移动,则OH-向负极A移动,错误;
D.碱性条件下,氧气在正极生成氢氧根离子,其电极反应式为:O2+2H2O+4e-=4OH-,错误。


科目:高中化学 来源: 题型:
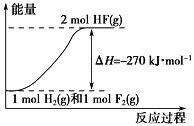
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,己知气体A在标准状况下相对氢气的密度为13,B可发生银镜反应,它们之间的转化关系如右图。请回答:

(1)有机物C中含有的官能团名称是________,反应③的反应类型是____________。
(2)反应①的原子利用率达100%,该反应的化学方程式是______________________。
(3)下列说法正确的是__________________。
A.反应④也能实现原子利用率100%
B.乙酸乙酯在氢氧化钠溶液中水解的反应叫作皂化反应
C.有机物A、B、C均能使酸性高锰酸钾溶液褪色
D.有机物B和D都可以与新制碱性氢氧化铜悬浊液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质A-F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;适当的条件下,它们之间可以发生如图所示的转化。
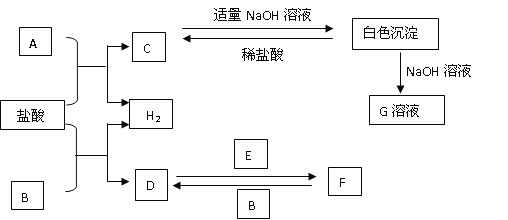
(1)A的原子结构示意图___;G溶液中溶质的化学式为___。
(2)请写出反应D→F的化学方程式:___。
(3)检验F中金属阳离子的常用试剂是___(填物质的化学式);现象是___。
(4)E物质可与石灰乳反应制取漂白粉,写出漂白粉的有效成分___。
(5)写出C与足量氢氧化钠溶液反应的离子方程式___。
(6)FeCl3溶液和氢氧化铁胶体的本质区别是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
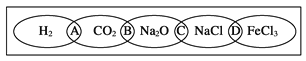
(1)请将分类依据代号填入相应的括号内:
(_______________)两种物质都不是电解质
(________________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________。
②证明有红褐色胶体生成的实验操作是____。
(Ⅱ)反应:
A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水只是氧化剂的是______(填序号),反应B中被氧化的元素名称是________。
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O, 硝酸在该反应中的作用是______ 还原剂与氧化剂的物质的量之比:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知
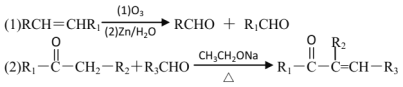
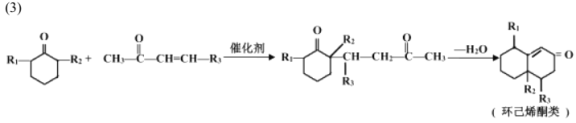
以下是化合物N ( 属于环己烯酮类 ) 的两步合成路线,F不含氯元素。
I步:
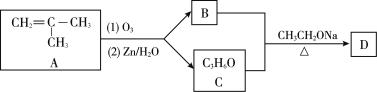
II步:
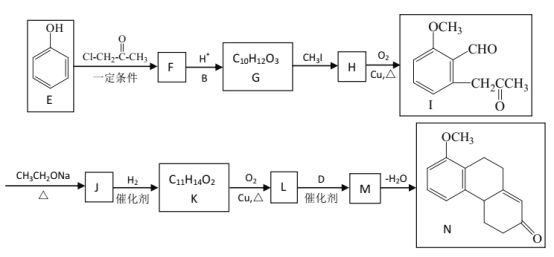
请回答:
(1)D中官能团名称是_______________。
(2)下列说法不正确的是_________________。
A.E生成F与G生成H的反应类型相同 B.J的结构简式是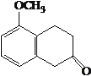
C.1mol I最多能和4mol H2加成 D.N的分子式为C17H20O2
(3)符合下列条件的G 的同分异构体有_____________________种,写出其中一种同分异构体的结构简式_________________。
①能与浓溴水反应产生白色沉淀②苯环上有两个取代基,且苯环上的一氯代物只有两种
③可在一定条件下发生水解反应和银镜反应
(4)写出方程式:B + C→D ________________________________________。
(5)以![]() 为原料,合成
为原料,合成 _______________________________________________________________ (用流程图表示,反应条件任选)。
_______________________________________________________________ (用流程图表示,反应条件任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或电离方程式书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.硝酸银溶液中加入铁粉:Ag++Fe=Fe2++Ag
C.硫酸氢钠的电离方程式:NaHSO4=Na+ + H+ + SO42-
D.碳酸氢钠的电离方程式:NaHCO3=Na+ + H++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水提取溴和镁的过程如下,下列说法不正确的是
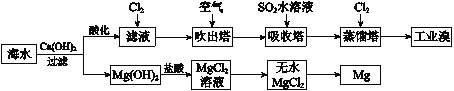
A. 工业溴中含少量Cl2,可用NaOH溶液除去
B. 工业上常利用电解熔融MgCl2冶炼金属镁
C. 富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D. 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
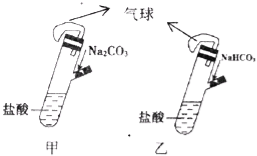
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com