
����Ŀ��KMnO4��һ�ֳ�����ǿ����������Ҫ���ڷ�������������ҩ�ȡ�����ij�����̿���Ҫ�ɷ�MnO2������Fe2O3��Al2O3��SiO2�ȣ����������ͨ�����¼����̼��ѳ�ȼúβ���е�SO2�����Ƶ�KMnO4����Ӧ�����Ѿ�ʡ�ԣ���

��֪��Ksp[Fe(OH)3]��4��10-38��Ksp[Al(OH)3]��1��10-33���ش��������⣺
��1��K2MnO4��Mn�Ļ��ϼ�Ϊ___________��
��2������A�ijɷ���_________����������Bʱ������������������_________��
��3������2�м���MnCO3������Ϊ_______________��
��4����ҺC�м���KMnO4ʱ������Ӧ�����ӷ���ʽ��_________________��
��5������4�з�Ӧ�Ļ�ѧ����ʽ��_______________��
��6������Ʊ�KMnO4��װ����ͼ��ʾ��b���Դ��______�����������Һ�����ѡ��_______���ӽ���Ĥ��������������������ʱ�������ĵ缫��ӦʽΪ_________��

���𰸡�+6 SiO2(���������) Fe(OH)3(����������) ������Һ��pH���ٽ�Fe3+��Al3+ˮ���Գ�����ʽ��ȥ 3Mn2+��2MnO4-��2H2O=5MnO2����4H+ 3MnO2��KClO3��6KOH=3K2MnO4��KCl��3H2O �� �� MnO42--e-=MnO4-
��������
SO2����MnO2��ϡH2SO4��Ӧ����MnSO4��Fe2O3��Al2O3����ϡH2SO4��SiO2���ܣ��õ�������A��SiO2����Һ�к���ϡH2SO4��Fe2(SO4)3��Al2(SO4)3��MnSO4����MnCO3�ܳ�ȥ��Һ��Al3+��Fe3+������BΪAl(OH)3��Fe(OH)3����Һ�к���MnSO4������ҺC�м���KMnO4��Һ�õ�MnO2��MnO2��KClO3��KOH��Ӧ�õ�K2MnO4��K2MnO4����ˮ����õ�KMnO4��
(1) K2MnO4��KԪ��Ϊ+1�ۡ�OԪ��Ϊ-2�ۣ����ݻ��ϼ۵Ĵ�����Ϊ0���ж�MnԪ�ػ��ϼۣ�
(2)AΪδ��Ӧ��SiO2���ܶȻ�����С���������ɳ�����
(3) MnCO3�ܺ�H+��Ӧ��������Һ��pH��
(4) KMnO4��Mn2+��Ӧ����MnO2������
(5)���ݷ�Ӧ�������ͷ�Ӧ������д����ʽ��
(6)����Ʊ�KMnO4ʱ��MnO42-ʧ���ӷ���������Ӧ���������Ϸ�Ӧ��aΪ������bΪ��������������ԭ�����������������ԭ��ظ�����������������K2MnO4������K+��ʣ�ࣻ���ʱ������ӦʽΪ��MnO42--e-�TMnO4-��
SO2����MnO2��ϡH2SO4��Ӧ����MnSO4��Fe2O3��Al2O3����ϡH2SO4��SiO2���ܣ���õ�������A��SiO2����Һ�к���ϡH2SO4�����������������������̣���MnCO3�ܳ�ȥ��Һ��Al3+��Fe3+������BΪ��������������������������Һ�к��������̣�����ҺC�м���KMnO4��Һ�õ�MnO2��MnO2��KClO3��KOH��Ӧ�õ�K2MnO4��K2MnO4����ˮ����õ�KMnO4��
(1)��K2MnO4��KԪ��Ϊ+1����OԪ��Ϊ-2�ۣ����ݻ��ϼ۵Ĵ�����Ϊ0�����ж�MnԪ�ػ��ϼ�=2��4-1��2=+6��
(2)AΪδ��Ӧ��SiO2���ܶȻ�����С���������ɳ���������Ksp[Fe(OH)3]=4��10-38��Ksp[Al(OH)3]=1��10-33������Fe(OH)3�����ɳ�����
(3) MnCO3�ܺ�H+��Ӧ��ʹ��Һ�����Լ������ʿɵ�����Һ��pH���ٽ�Fe3+��Al3+ˮ����Fe(OH)3��Al(OH)3��ʽ������ȥ��
(4) KMnO4��Mn2+��Ӧ����MnO2���������ӷ���ʽΪ3Mn2+��2MnO4-��2H2O=5MnO2����4H+��
(5)���ݷ�Ӧ��������Ϸ�Ӧ����������4�Ļ�ѧ����ʽΪ3MnO2+KClO3+6KOH�T3K2MnO4+KCl+3H2O��
(6)��ⷨ�Ʊ�KMnO4ʱ��MnO42-��������ʧ���ӷ���������Ӧ��aΪ������bΪ��������������ԭ�����������������ԭ��ظ�������b���Ӹ�����������������K2MnO4�����¼�������ʣ�࣬b�缫�����������������ӣ����Լ�����ͨ������Ĥ�����Ҳ࣬��ĤΪ�����ӽ���Ĥ�����ʱ������ӦʽΪ��MnO42--e-=MnO4-��


 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���ǣ� ��
A.CaCO3 ![]() CaO+CO2��B.SO3 + H2O=H2SO4
CaO+CO2��B.SO3 + H2O=H2SO4
C.AgNO3+NaCl=AgCl��+NaNO3D.Fe+CuSO4=FeSO4+Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����25�桢101kPa�£�16g�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�352kJ�����������ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ_______________________________��
��2����֪����CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ��H1=-870.3kJ/mol��
��C(s)+O2(g)=CO2(g) ��H2=-393.5kJ/mol
��H2(g)+1/2O2(g)=H2O(l) ��H3=-285.8kJ/mol��
��2C(s)+2H2(g)+O2(g)= CH3COOH(l)�ķ�Ӧ����______________
��3����ͼ��N2��H2��Ӧ����2mol NH3�����������仯ʾ��ͼ��
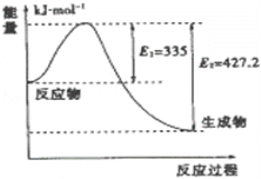
�������ÿ����1mol NH3�ų�����Ϊ��________���淴Ӧ����Ļ��Ϊ__________________ kJ/mol��
������ʼʱ�������ڷ���1mol N2��3mol H2����ƽ���N2��ת����Ϊ20%����Ӧ�ų�������ΪQ1 kJ����Q1����ֵΪ__________________��
��4����50mL0.50mol/L������50mL0.55mol/LNaOH��Һ�����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
�����ô�������������ʵ�飬�����к��ȵ���ֵ��________(�ƫ��ƫС������Ӱ�족����ͬ)��
������70mL0.50mol/L�������ʵ�飬�����к�����ֵ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʻ�ṹ�У�����ͬ����Ԫ����ɵ���(�� ��)
A. ���̴���֬���ᡢ֬��ø
B. DNA��RNA����֬
C. �����ᡢ�����ᡢ����
D. �Լ��ء���ά�ء��ȵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��SO2��Cl2�Ļ�������м���Ʒ����Һ������Һ��ɫ��������ɫ��Һ�ֳ����ݣ����ν���ʵ�飬ʵ�������ʵ�������¼���£�
��� | �� | �� | �� |
ʵ����� |
|
|
|
ʵ������ | ��Һ����죬��ֽ������ | ��Һ����죬��ֽ��ɫ | ���ɰ�ɫ���� |
����ʵ������У�����ȷ����
A.��˵��Cl2����ȫ����
B.������ֽ��ɫ��ԭ���ǣ�SO2��I2��2H2O��H2SO4��2HI
C.��������BaCl2��Һ����Ba��NO3��2��Һ��Ҳ��˵��SO2��Cl2����ΪSO42��
D.��ʵ�����м��Ⱥ���Һ����죬˵����Һ��Ʒ���ѱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ����һ����кܸ�Ӧ�ü�ֵ����ɫ�ܼ��ʹ��������е�EMIM+������H��C��N����Ԫ����ɣ��ṹ��ͼ��ʾ���ش��������⣺

(1)̼ԭ�Ӽ۲���ӵĹ������ʽΪ__________����̬̼ԭ���У��������ռ�ݵ�����ܼ��ĵ���������ͼΪ_________�Ρ�
(2)���ݼ۲���ӶԻ������ۣ�NH3��NO3-��NO2-�У�����ԭ�Ӽ۲���Ӷ�����ͬ�������������ӵ���_______��NH3��PH3�ķе�ߣ�ԭ����_________��
(3)��Ԫ�صĵ�һ�����ܱ�ͬ��������Ԫ�ض����ԭ����____________��
(4)EMIM+�����У�̼ԭ�ӵ��ӻ��������Ϊ______�������еĴ��������÷���![]() ��ʾ������m���������γɵĴ�����ԭ������n���������γɵĴ��������������籽�����еĴ������ɱ�ʾΪ
��ʾ������m���������γɵĴ�����ԭ������n���������γɵĴ��������������籽�����еĴ������ɱ�ʾΪ![]() ������EMIM+�����еĴ�����Ӧ��ʾΪ________��
������EMIM+�����еĴ�����Ӧ��ʾΪ________��

(5)����������Ӳ�Ƚ����ڽ��ʯ�������ȶ���Զ���ڽ��ʯ���侧���ṹ��ͼ��ʾ����������������_______���壬������ԭ�ӵ���λ��Ϊ_______����֪�������������ܶ�Ϊdg/cm3��Bԭ�Ӱ뾶Ϊxpm��Nԭ�Ӱ뾶Ϊypm�������ӵ�������ֵΪNA����þ�����ԭ�ӵĿռ�������Ϊ________���г������ļ���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA (g) +nB (g)![]() pc (g) ���ﵽƽ������ߜض�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����
pc (g) ���ﵽƽ������ߜض�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����
��1���÷�Ӧ���淴ӦΪ____�ȷ�Ӧ����m+n____p (����>���� ��=�� ����<������
��2����ѹʱ��A����������______.(����������������С����������������ͬ��
��3��������B (������䣩����A��ת����_____��B��ת����_________��
��4�������ߜضȣ���ƽ��ʱB��C��Ũ��֮�Ƚ�__________��
��5�������������ƽ��ʱ��������������ʵ���______________��
��6����B����ɫ���ʣ�A��C����ɫ�������C (������䣩ʱ�������ɫ______����ά��������ѹǿ���䣬��������ʱ���������ɫ______(������������ ����dz������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀ����֪����H2(g)+ ![]() O2(g)=2H2O(g) ��H1=akJ/mol
O2(g)=2H2O(g) ��H1=akJ/mol
��2H2(g)+O2(g)=2H2O(g) ��H2=b kJ/mol
��H2(g)+ ![]() O2(g)=H2O(l) ��H3=ckJ/mol��
O2(g)=H2O(l) ��H3=ckJ/mol��
��2H2(g)+O2(g)=2H2O(l) ��H4=dkJ/mol��
���й�ϵ��ȷ����
A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������M2O7X-��S2-����������Һ�з������·�Ӧ��aM2O7X- +3S2- +cH+==2M3+ +eS+f H2O,��M2O7X-��M�Ļ��ϼ�Ϊ ( )
A. +4 B. +5 C. +6 D. +7
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com