
【题目】(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______________________________.
(2)已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol;
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol,
则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的反应热是______________
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,
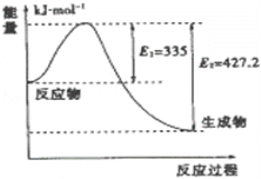
①请计算每生成1mol NH3放出热量为:________,逆反应所需的活化能为__________________ kJ/mol。
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为__________________;
(4)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
①如用醋酸代替盐酸进行实验,所测中和热的数值将________(填“偏大”“偏小”或“无影响”,下同);
②如用70mL0.50mol/L盐酸进行实验,所测中和热数值将__________。
【答案】CH3OH(l) +![]() O2(g) =CO2(g)+2H2O(g) △H=-352kJ/mol-488.3kJ/mol46.1kJ213.618.44偏小无影响
O2(g) =CO2(g)+2H2O(g) △H=-352kJ/mol-488.3kJ/mol46.1kJ213.618.44偏小无影响
【解析】
(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704kJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+![]() O2(g)═CO2(g)+2H2O (l)△H=-704kJ/mol;
O2(g)═CO2(g)+2H2O (l)△H=-704kJ/mol;
(2)已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol;
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol,
根据盖斯定律,由②![]() 2+③
2+③![]() 2-①得反应2C(s)+2H2(g)+O2(g)= CH3COOH(l) △H=2△H2+2△H3-△H1=-393.5kJ/mol
2-①得反应2C(s)+2H2(g)+O2(g)= CH3COOH(l) △H=2△H2+2△H3-△H1=-393.5kJ/mol![]() 2-285.8kJ/mol
2-285.8kJ/mol![]() 2-(-870.3kJ/mol)=-488.3kJ/mol,则反应热是-488.3kJ/mol;
2-(-870.3kJ/mol)=-488.3kJ/mol,则反应热是-488.3kJ/mol;
(3)①该反应的焓变△H=E1-E2=335kJ/mol-427.2kJ/mol=-92.2kJ/mol,所以每生成1molNH3放出热量为46.1kJ;逆反应所需的活化能为![]() E2=
E2=![]() 427.2kJ/mol=213.6kJ/mol;
427.2kJ/mol=213.6kJ/mol;
②N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
1 3 0
0.2 0.6 0.4
生成0.4mol氨气放热=![]() ×92.2kJ=18.44kJ;
×92.2kJ=18.44kJ;
(4)①醋酸为弱酸,电离过程为吸热过程,所以醋酸(CH3COOH)代替HCl溶液反应,反应放出的热量小于57.3kJ;所测中和热的数值将偏小;
②反应放出的热量和所用酸以及碱的量的多少有关,如用70mL0.50mol/L盐酸进行实验,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用70mL0.50mol/L盐酸进行实验,进行上述实验,测得中和热数值相等,故无影响。


科目:高中化学 来源: 题型:
【题目】已知常温常压下,N2和H2生成2molNH3放出92.4KJ热量,在同温下向恒容密闭容器中通入1molN2和3molH2,达平衡时放出热量为Q1KJ,向另一体积相同的容器中通入0.5molN2、1.5molH2和1molNH3,相同条件下,达平衡时放出热量为Q2KJ,则下列正确的是
A. 2Q2﹤Q1﹤92.4 B. 2Q2=Q1=92.4 C. Q1﹤Q2﹤92.4 D. Q1=Q2﹤92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学知识与生产、生活密切相关。下列说法错误的是
A.SiO2是将太阳能转变为电能的常用材料B.Al(OH)3胶体具有吸附性,可用作净水剂
C.硫酸钡可用于胃肠X射线造影检查D.铝合金大量用于高铁建设
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b B. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C. 混合溶液的pH=7 D. 混合溶液中,c(H+) =![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. 平衡向正反应方向移动
B. a<c+d
C. D的体积分数增大
D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是氮元素的一种氧化物。下图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列有关反应和NO性质的说法中,正确的是
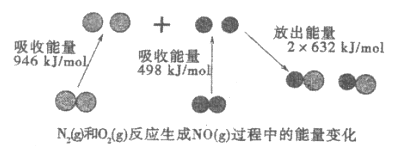
A.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
B.1mol N2(g)和1mol O2(g)反应生成2molNO(g),放出能量180 kJ
C.在1 L的密闭容器中N2(g)和O2(g)反应生成NO(g),10分钟内减少1mol N2,则10分钟内化学反应的的平均速率可表示为v(NO)=0.1mol/(L·min)
D.N2(g)分子中化学键键能大于O2(g)分子中化学键键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿(主要成分MnO2,还有Fe2O3、Al2O3、SiO2等)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得KMnO4(反应条件已经省略)。

已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-33。回答下列问题:
(1)K2MnO4中Mn的化合价为___________。
(2)滤渣A的成分是_________,析出沉淀B时,首先析出的物质是_________。
(3)步骤2中加入MnCO3的作用为_______________。
(4)滤液C中加入KMnO4时发生反应的离子方程式是_________________。
(5)步骤4中反应的化学方程式是_______________。
(6)电解制备KMnO4的装置如图所示。b与电源的______极相连,电解液中最好选择_______离子交换膜(填“阳”或“阴”)。电解时,阳极的电极反应式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应:2A(g)+3B(g)![]() xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
xC(g)+D(g)中,已知:起始浓度A为5mol/L,B为3mol/L,C的反应速率为0.5mol/(L·min),2min后,测得D的浓度为0.5mol/L。则关于此反应的下列说法正确的是( )
A. 2min末时A和B的浓度之比为5:3
B. x=1
C. 2min末时B的浓度为1.5mol/L
D. 2min末时A的消耗浓度为0.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com