
����Ŀ����֪���³�ѹ�£�N2��H2����2molNH3�ų�92.4KJ��������ͬ����������ܱ�������ͨ��1molN2��3molH2����ƽ��ʱ�ų�����ΪQ1KJ������һ�����ͬ��������ͨ��0.5molN2��1.5molH2��1molNH3,��ͬ������,��ƽ��ʱ�ų�����ΪQ2KJ����������ȷ����
A. 2Q2��Q1��92.4 B. 2Q2=Q1=92.4 C. Q1��Q2��92.4 D. Q1=Q2��92.4
���𰸡�A
��������
���ܱ���������ͨ��1mol N2��3mol H2���ﵽƽ��ʱ�������͵���������ȫת�����ﵽƽ��ʱ�ų�����Q1kJС��92.4kJ���ٶ�0.5mol N2��1.5mol H2��ȫ��Ӧ���ﵽƽ��ʱ�ų�����Q2 kJ������N2��g��+3H2��g��2NH3��g����H=-92.4kJmol-1��֪���ų�������Ϊ��![]() =46.2kJ�����ںϳɰ��ǿ��淴Ӧ���ʷ�Ӧ�ﲻ����ȫ��Ӧ�����Էų�������Q2С��46.2kJ���õ�Q1��2Q2������������֪��2Q2��Q1��92.4����ѡA��
=46.2kJ�����ںϳɰ��ǿ��淴Ӧ���ʷ�Ӧ�ﲻ����ȫ��Ӧ�����Էų�������Q2С��46.2kJ���õ�Q1��2Q2������������֪��2Q2��Q1��92.4����ѡA��


 ������ϵ�д�
������ϵ�д� �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.ϡ������Һ�в�����H2SO4����
B.�����ܵ��������һ���ܴﵽ����ƽ��
C.�Ȼ�����Һ�ڵ��������µ���������Ӻ�������
D.��ˮ��ȫ����NH4+��OH-�����Ӵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯȼ��֮һ����Ȼ��������Ҫ�ɷ��Ǽ��飮��ش��������⣮
(1)����ĵ���ʽ�ǣ�______________________��
(2)�����������ڹ����·�Ӧ�IJ�����_______________�֣��÷�Ӧ��������________��
(3)����Ŀռ乹����________________����֤���乹�͵�ʵ����ʵ�ǣ�___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ���ǣ� ��
A.CaCO3 ![]() CaO+CO2��B.SO3 + H2O=H2SO4
CaO+CO2��B.SO3 + H2O=H2SO4
C.AgNO3+NaCl=AgCl��+NaNO3D.Fe+CuSO4=FeSO4+Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ�������ж���ȷ����
��I2(g)+ H2(g) ![]() 2HI(g) ��H = ��9.48 kJ/mol
2HI(g) ��H = ��9.48 kJ/mol
��I2(s)+ H2(g) ![]() 2HI(g) ��H = +26.48 kJ/mol
2HI(g) ��H = +26.48 kJ/mol
A. 254 g I2(g)��ͨ��2 g H2(g)����Ӧ����9.48 kJ
B. 1 mol��̬����1 mol��̬���������������17.00 kJ
C. ��Ӧ�ٵIJ���ȷ�Ӧ�ڵIJ����ȶ�
D. ��Ӧ�ڵķ�Ӧ���������ȷ�Ӧ�ٵķ�Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��ԭ��������������ij���������Ԫ�أ�X��ij���⻯����ʹʪ��ĺ�ɫʯ����ֽ������Y��һ�ֺ���������Ϊ18��������Ϊ10����ͬ����Ԫ����Z�ļ����Ӱ뾶��С��W�ĵ��������õİ뵼����ϡ�����˵������ȷ����
A. ����̬�⻯���ȶ��ԣ�W >X
B. YԪ�ص����ԭ������Ϊ18
C. X2H4�ķ����м��Լ��ͷǼ��Լ���Ŀ��Ϊ4��l
D. ���Z�������Ȼ������ұ������Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�һ�����ܱ������з������淴Ӧ��A(g)��2B(g) ![]() 2C(g)����H>0��ƽ���ƶ���ϵ��ͼ��ʾ��������˵����ȷ����
2C(g)����H>0��ƽ���ƶ���ϵ��ͼ��ʾ��������˵����ȷ����

A. p1>p2��������ɱ�ʾA����������
B. p1<p2��������ɱ�ʾC����������
C. p1>p2��������ɱ�ʾ��������ƽ��Ħ������
D. p1<p2��������ɱ�ʾA��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����25�桢101kPa�£�16g�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�352kJ�����������ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ_______________________________��
��2����֪����CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ��H1=-870.3kJ/mol��
��C(s)+O2(g)=CO2(g) ��H2=-393.5kJ/mol
��H2(g)+1/2O2(g)=H2O(l) ��H3=-285.8kJ/mol��
��2C(s)+2H2(g)+O2(g)= CH3COOH(l)�ķ�Ӧ����______________
��3����ͼ��N2��H2��Ӧ����2mol NH3�����������仯ʾ��ͼ��
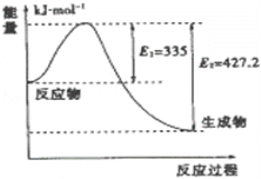
�������ÿ����1mol NH3�ų�����Ϊ��________���淴Ӧ����Ļ��Ϊ__________________ kJ/mol��
������ʼʱ�������ڷ���1mol N2��3mol H2����ƽ���N2��ת����Ϊ20%����Ӧ�ų�������ΪQ1 kJ����Q1����ֵΪ__________________��
��4����50mL0.50mol/L������50mL0.55mol/LNaOH��Һ�����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
�����ô�������������ʵ�飬�����к��ȵ���ֵ��________(�ƫ��ƫС������Ӱ�족����ͬ)��
������70mL0.50mol/L�������ʵ�飬�����к�����ֵ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA (g) +nB (g)![]() pc (g) ���ﵽƽ������ߜض�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����
pc (g) ���ﵽƽ������ߜض�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����
��1���÷�Ӧ���淴ӦΪ____�ȷ�Ӧ����m+n____p (����>���� ��=�� ����<������
��2����ѹʱ��A����������______.(����������������С����������������ͬ��
��3��������B (������䣩����A��ת����_____��B��ת����_________��
��4�������ߜضȣ���ƽ��ʱB��C��Ũ��֮�Ƚ�__________��
��5�������������ƽ��ʱ��������������ʵ���______________��
��6����B����ɫ���ʣ�A��C����ɫ�������C (������䣩ʱ�������ɫ______����ά��������ѹǿ���䣬��������ʱ���������ɫ______(������������ ����dz������������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com