
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A.①说明Cl2被完全消耗
B.②中试纸褪色的原因是:SO2+I2+2H2O=H2SO4+2HI
C.③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42-
D.在实验②中加热后溶液不变红,说明溶液中品红已被氧化
【答案】C
【解析】
A项、①加热后溶液不变红,湿润的淀粉碘化钾试纸不变蓝,说明溶液中没有氯气,则Cl2被SO2完全消耗,故A正确;
B项、实验②中试纸褪色,说明二氧化硫过量,加热后产生的二氧化硫气体与碘水发生氧化还原反应,使试纸褪色,反应的化学方程式为SO2 + I2 + 2H2O = H2SO4 + 2HI,故B正确;
C项、酸性条件下,硝酸根离子能将亚硫酸根离子氧化为硫酸根,实验③中若将BaCl2溶液换成Ba(NO3)2溶液,不能说明SO2被Cl2氧化为SO42,故C错误;
D项、二氧化硫使品红溶液褪色后,加热会重新变为红色,实验②中二氧化硫过量,加热后溶液不恢复红色,说明品红溶液被氯气氧化,故D正确;
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b B. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C. 混合溶液的pH=7 D. 混合溶液中,c(H+) =![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO是氮元素的一种氧化物。下图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列有关反应和NO性质的说法中,正确的是
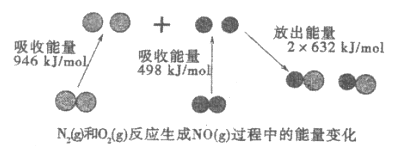
A.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
B.1mol N2(g)和1mol O2(g)反应生成2molNO(g),放出能量180 kJ
C.在1 L的密闭容器中N2(g)和O2(g)反应生成NO(g),10分钟内减少1mol N2,则10分钟内化学反应的的平均速率可表示为v(NO)=0.1mol/(L·min)
D.N2(g)分子中化学键键能大于O2(g)分子中化学键键能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将AgNO3溶液分别滴加到浓度均为0.01mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是

A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿(主要成分MnO2,还有Fe2O3、Al2O3、SiO2等)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得KMnO4(反应条件已经省略)。

已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-33。回答下列问题:
(1)K2MnO4中Mn的化合价为___________。
(2)滤渣A的成分是_________,析出沉淀B时,首先析出的物质是_________。
(3)步骤2中加入MnCO3的作用为_______________。
(4)滤液C中加入KMnO4时发生反应的离子方程式是_________________。
(5)步骤4中反应的化学方程式是_______________。
(6)电解制备KMnO4的装置如图所示。b与电源的______极相连,电解液中最好选择_______离子交换膜(填“阳”或“阴”)。电解时,阳极的电极反应式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 5.6g铁与稀硝酸反应,转移电子数一定为0.3NA
B. 密闭容器中,1molN2和3molH2催化反应后分子总数大于2NA
C. 3.2gN2H4中含有共用电子对的总数为0.6NA
D. 室温下,pH=1的H3PO4溶液中,含有0.1NA个H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com