
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LCCl4含有的分子数为NA
B.常温常压下,64 g SO2含有的的原子数为3NA
C.78gNa2O2与水反应,转移电子个数为NA
D.配制物质的量浓度为0.5mol·L-1的MgCl2溶液,需MgCl2 47.5 g
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含有硫酸镁和硫酸钠两种溶质,选择合适的试剂将溶液中的镁离子转化为沉淀分离出来,设计实验流程如下:
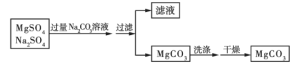
(1)欲证明滤液中存在![]() 、
、![]() ,选用的方案是先取少量的滤液,向其中滴加过量的______,发现有气泡生成,再向其中加入______溶液,出现白色沉淀,则可证明
,选用的方案是先取少量的滤液,向其中滴加过量的______,发现有气泡生成,再向其中加入______溶液,出现白色沉淀,则可证明![]() 、
、![]() 均存在。
均存在。
(2)洗涤碳酸镁沉淀的方法是____________。
(3)如何检验碳酸镁沉淀是否洗涤干净?____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:
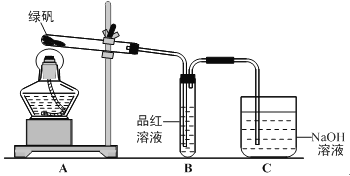
(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是 ,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是 。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中 。(填字母)
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:
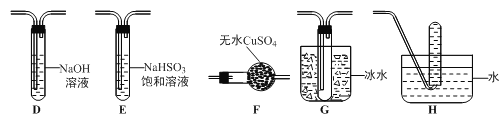
①丙组同学的实验装置中,依次连接的合理顺序为 。
②能证明绿矾分解产物中有O2的实验操作及现象是 。
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、 ;选用的试剂为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
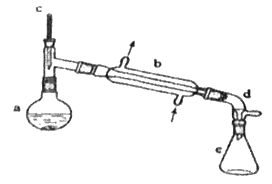
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
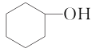
![]()
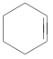 +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。某兴趣小组同学采用镁屑与液溴为原料制备无水MgBr2,设计装置如图所示。已知:Mg与Br2反应剧烈放热;MgBr2具有强吸水性。下列说法正确的是( )
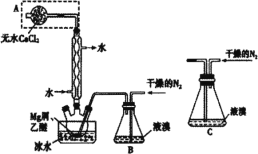
A.冷凝管中冷水进、出口方向错误
B.实验中可以用干燥的空气代替干燥的N2
C.为防止反应过于剧烈,不能用装置C代替装置B
D.装有无水CaCl2固体A的作用是吸收挥发的溴蒸气,防止污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,可以由废旧锂钴电池正极材料(主要含Fe、Al、硅等杂质)回收钴,再用电化学法制得CoFe2O4。其流程如图所示(过程中所加试剂均足量)
Ⅰ.废旧电池中钴的回收
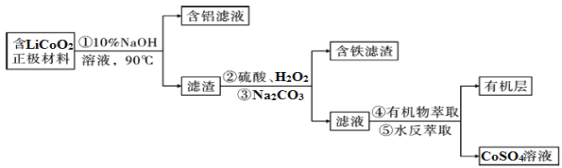
(1)写出过程②中LiCoO2与H2O2发生反应的化学方程式:__________________________。
(2)过程③Na2CO3的主要作用为__________________。
Ⅱ.电解法制得钴铁合金
(3)配制0.050molL1FeSO4和0.025molL1CoSO4的混合溶液,用铜作阴极、石墨作阳极进行电解,获得CoFe2合金。阴极的电极方程式为:___________。
Ⅲ.阳极氧化法制得钴铁氧体
(4)以1.500molL1NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为__________________________。
(5)当电路上有0.4mol电子转移时,阳极电极材料增重质量为3.4g,与理论值不符,其原因可能为_______________。
(6)由废旧锂钴电池制CoFe2O4的现实意义在于:_____(写一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、浓度均为0.2mol·L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)的变化如图所示。下列说法不正确的是
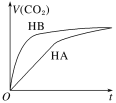
A. 酸性:HB>HA>H2CO3
B. 恰好反应时,所得两溶液中:c(A-)>c(B-)
C. 上述三种溶液中由水电离出的c(OH-)的相对大小:③>①>②
D. HA溶液和NaHCO3溶液恰好反应,所得的溶液中:c(A-)+c(HA)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去。)
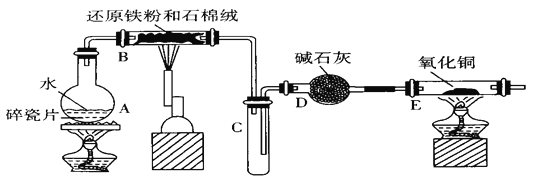
(1)装置B中发生反应的化学方程式是_____________________________________。
(2)装置E中的现象是_____________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤,简述检验滤液中Fe3+的操作方法:_____________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
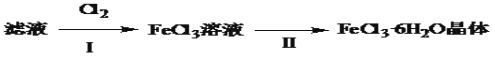
①步骤Ⅰ中通入Cl2发生反应的离子方程式______________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 非金属元素形成的离子一定是阴离子
B. 非金属单质在氧化还原反应中一定是氧化剂
C. 某元素从化合态变为游离态时,一定被还原
D. 金属阳离子被还原不一定得到金属单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com