
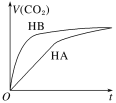
【题目】等体积、浓度均为0.2mol·L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)的变化如图所示。下列说法不正确的是
A. 酸性:HB>HA>H2CO3
B. 恰好反应时,所得两溶液中:c(A-)>c(B-)
C. 上述三种溶液中由水电离出的c(OH-)的相对大小:③>①>②
D. HA溶液和NaHCO3溶液恰好反应,所得的溶液中:c(A-)+c(HA)=0.1mol·L-1
【答案】B
【解析】
A.由题图可知,HB溶液与NaHCO3溶液反应的速率较快,说明HB溶液中氢离子浓度较大,所以酸性:HB>HA>H2CO3,故A正确;
B.反应结束后所得两溶液分别为NaA溶液、NaB溶液,根据“越弱越水解”,则c(B-)>c(A-),故B错误;
CNaHCO3水解促进水的电离,酸的酸性越强,对水的电离的抑制程度越大,所以HB对水的电离的抑制程度最大,三种溶液中由水电离出的c(OH-)的相对大小:NaHCO3溶液>HA溶液>HB溶液,故C正确;
D.根据物料守恒可知,HA溶液和NaHCO3溶液反应所得溶液中c(A-)+c(HA)=0.1 mol·L-1,故D正确;
故答案为B。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
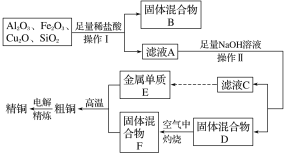
已知:Cu2O+2H+===Cu+Cu2++H2O。
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的可能存在形式为________(填离子符号),生成该离子的方程式为_____,
若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(3)金属E和固体F反应发生的某一反应可用于焊接钢轨,该反应化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示![]() 图中有些反应的生成物和反应的条件没有标出
图中有些反应的生成物和反应的条件没有标出![]() 。
。
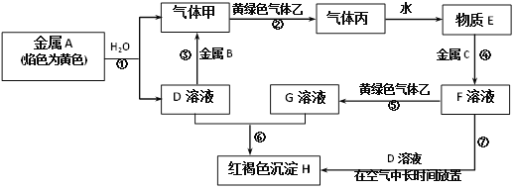
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LCCl4含有的分子数为NA
B.常温常压下,64 g SO2含有的的原子数为3NA
C.78gNa2O2与水反应,转移电子个数为NA
D.配制物质的量浓度为0.5mol·L-1的MgCl2溶液,需MgCl2 47.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以锈蚀程度很大的废铁屑为原料制备FeCl3·6H2O晶体的流程可简要表示如下:
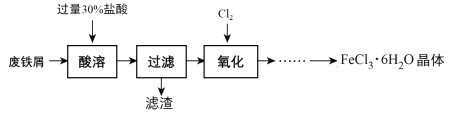
已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
试回答下列问题:
(1) “酸溶”过程中发生主要反应有:
①Fe + 2H+= Fe2++ H2↑;②Fe2O3+ 6 H+= 2Fe3++ 3H2O;③__________________。(用离子方程式)
(2) “酸溶”需控制温度在40℃左右,最佳的加热方式是____________。
(3) “氧化”过程可在下图所示装置中进行。
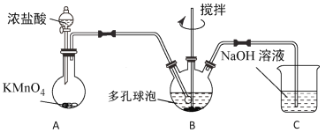
①装置A中KMnO4与浓盐酸反应生成MnCl2和Cl2,其离子方程式为______________________。
②装置C的作用是__________________________________________________。
③为使Cl2能充分发生反应,除在B中使用多孔球泡和搅拌外,实验中可采取的措施是_____________________________________________________________________。
④证明装置B溶液中Fe2+已完全________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲中含有的化学键类型是___;常温下丁溶液显___性(填“酸”或“碱”或“中”),原因是____(用离子方程式表示);
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1∶2(M均显+1价),原子序数B大于A。回答下列问题:
①写出加热条件下上述生成丙的化学方程式____;
②已知常温下弱电解质的电离平衡常数如下:一水合氨![]() ,戊:
,戊:![]() ,
,![]() 。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为
。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为![]() 的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中
的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____
____![]() (同上)。
(同上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)=CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应.测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。下列说法正确的是

A.该反应的△H<O,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:v逆(状态A)>v逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,
达平衡时CH3OH的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是![]()
A.稀硝酸与过量的铁屑反应:![]()
B.硫酸铝溶液与过量的氨水反应:![]()
C.苯酚钠的水溶液中通入少量的![]() :
:![]()
D.醋酸钠的水解反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业水合碱碳酸镁简称轻质碳酸镁【3MgCO3.Mg(OH)2.3H2O】,相对密度小,质轻而松,广泛用于橡胶制品、防火保湿材料和日货用品中等。一种以富含氯化镁。硫酸镁的卤水和白云石【CaMg(CO3)2】为原料的卤水碳化法生产轻质碳酸镁的工艺流程如下:
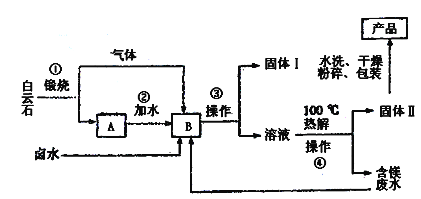
已知:MgCO3比CaCO3更易与CO2反应生成可溶性盐。
(1)为了使第①步白云石煅烧得更充分,常常要对矿石进行__预处理。
(2)第③步和第④步操作的名称是__,在实验室进行该操作时需要的玻璃仪器有
__。
(3)固体I的主要成分为____,固体II的主要成分为____。水洗固体II时,如何判断已经洗净,请简述其过程:____。
(4)写出第④步反应的化学方程式:____。
(5)该流程中能同体现提高效益、减少废物排放思想的两项设计是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com