
【题目】实验室以锈蚀程度很大的废铁屑为原料制备FeCl3·6H2O晶体的流程可简要表示如下:
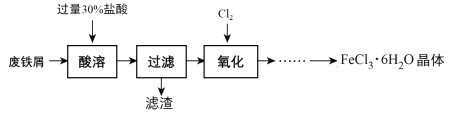
已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
试回答下列问题:
(1) “酸溶”过程中发生主要反应有:
①Fe + 2H+= Fe2++ H2↑;②Fe2O3+ 6 H+= 2Fe3++ 3H2O;③__________________。(用离子方程式)
(2) “酸溶”需控制温度在40℃左右,最佳的加热方式是____________。
(3) “氧化”过程可在下图所示装置中进行。
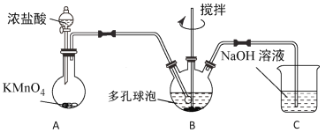
①装置A中KMnO4与浓盐酸反应生成MnCl2和Cl2,其离子方程式为______________________。
②装置C的作用是__________________________________________________。
③为使Cl2能充分发生反应,除在B中使用多孔球泡和搅拌外,实验中可采取的措施是_____________________________________________________________________。
④证明装置B溶液中Fe2+已完全________________________________________________________________。
【答案】2Fe3++Fe=3Fe2+ 在40℃水浴中加热 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8 H2O 吸收Cl2,防止污染空气 减慢分液漏斗中浓盐酸的滴加速度(或增加B中溶质的浓度) 取B中溶液于试管中,滴加少量Fe3[Fe(CN)6]2溶液,若无蓝色沉淀生成,则证明亚铁离子已被完全氧化
【解析】
根据实验装置图可知,在A中用高锰酸钾与浓盐酸制得氯气,氯气中有挥发的氯化氢在B装置中用饱和食盐水除去,氯得的氯气通入氢氧化钾溶液中搅拌,生成次氯酸钾,实验中氯气尾气在D装置中用氢氧化钾溶液吸收。
(1)因为氧化性的强弱:Fe3+>H+>Fe2+书写离子反应方程式为:Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+═3Fe2+;
(2)“酸浸”时需控制温度为40℃左右,可以采用的加热方式是40℃水浴加热,故答案为:40℃水浴加热;
(3)①KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
②氯气有毒,应该用碱液吸收,防止污染环境,故答案为:吸收多余的氯气,防止污染环境;
③为提高Cl2的吸收效率,可减慢分液漏斗中浓盐酸的滴加速度控制Cl2的流速、可适当升高B中溶液温度、增大B中混合溶液的浓度、加快搅拌等等措施,故答案为:减慢分液漏斗中浓盐酸的滴加速度(或增加B中溶质的浓度);
④Fe2+能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀,故答案为:取B中少量溶液,滴加K3[Fe(CN)6]溶液,如果无蓝色沉淀生成,则说明Fe2+已完全被氧化成Fe3+的,反之则没有。


科目:高中化学 来源: 题型:
【题目】某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
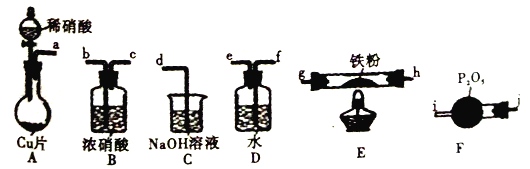
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
A. 装置的连接顺序为a![]() f
f![]() e
e![]() j
j![]() i
i![]() h
h![]() g(或g
g(或g![]() h)
h)![]() b
b![]() c
c![]() d
d
B. 装置E中发生的化学方程式为2NO+2Fe![]() 2FeO+N2
2FeO+N2
C. 装置D的作用是吸收挥发出来的硝酸和产生NO2
D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
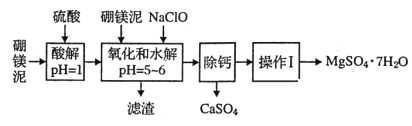
(1)实验中需用1mol/L的硫酸480mL,若用18.4mol/L的浓硫酸来配置,量取浓硫酸时需使用的量筒规格为(_______)。
A 10mL B 20mL C 50mL D 100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________________;滤渣中除含有氢氧化铁、氢氧化铝外还有_________。
(3)在“除钙”前需检验滤液中Fe3+是否被除尽,简述检验方法_____________________。
(4)已知硫酸镁、硫酸钙的溶解度如下表
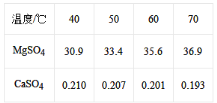
“除钙”是将;硫酸镁和硫酸钙混合溶液中的硫酸钙除去根据上表数据,采取的操作是_______________、趁热过滤、_________、____________,便得到比较纯净的硫酸镁。
(5)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。某兴趣小组同学采用镁屑与液溴为原料制备无水MgBr2,设计装置如图所示。已知:Mg与Br2反应剧烈放热;MgBr2具有强吸水性。下列说法正确的是( )
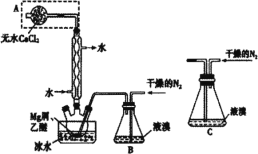
A.冷凝管中冷水进、出口方向错误
B.实验中可以用干燥的空气代替干燥的N2
C.为防止反应过于剧烈,不能用装置C代替装置B
D.装有无水CaCl2固体A的作用是吸收挥发的溴蒸气,防止污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知 4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
①该反应在________________(填“高温、低温或任何温度”)下能自发进行。
②对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是_______(填序号)。
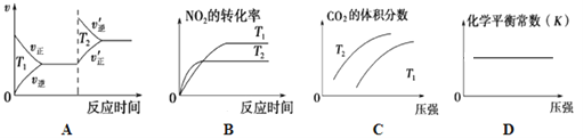
③某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙( 填“>、=、<或不确定”,下同),NO2的浓度:甲______乙。

(2)柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。
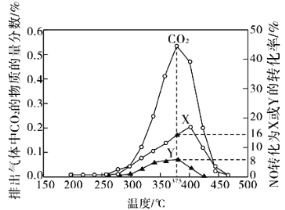
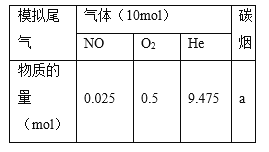
①375℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为________。
②实验过程中采用NO模拟NOx,而不采用NO2的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、浓度均为0.2mol·L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)的变化如图所示。下列说法不正确的是
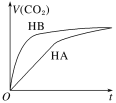
A. 酸性:HB>HA>H2CO3
B. 恰好反应时,所得两溶液中:c(A-)>c(B-)
C. 上述三种溶液中由水电离出的c(OH-)的相对大小:③>①>②
D. HA溶液和NaHCO3溶液恰好反应,所得的溶液中:c(A-)+c(HA)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铝样品中含有氧化铁和二氧化硅(一种酸性氧化物)杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。回答下列问题:
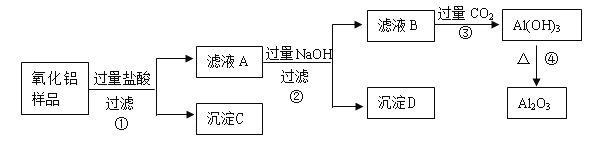
(1)在操作①中要用到的玻璃仪器有_____________________________________________;
(2)沉淀C的化学式是_____________。滤液B中含有的溶质有__________(写化学式);
(3)步骤③的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
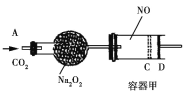
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】继密胺树脂/石墨烯量子点复合微球新型白光发光材料后,2019年8月13日中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料![]() 并获得了该化合物的LED器件。
并获得了该化合物的LED器件。
(1)基态O原子能量最高的电子,其电子云在空间有_________个延展方向;C原子的基态电子排布式为_____________;
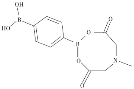
(2)NO3-与![]() 互为等电子体,构型为__________;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为__________、__________。
互为等电子体,构型为__________;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为__________、__________。
(3)![]() 可用
可用![]() 检验,其对应的酸有两种,分别为硫氰酸(HSC≡N)和异硫氰酸(HN=C=S),这两种酸中沸点较高的是____________,试分析原因:________;热稳定性:
检验,其对应的酸有两种,分别为硫氰酸(HSC≡N)和异硫氰酸(HN=C=S),这两种酸中沸点较高的是____________,试分析原因:________;热稳定性:![]() _______(填“<”“>”或“=”)
_______(填“<”“>”或“=”)![]() 。
。
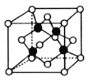
(4)超高热导率半导体材料——砷化硼(BAs)晶胞结构如图所示(As位于体内,B位于顶点和面心),已知晶胞参数为a pm,阿伏加德罗常数的值为![]() ,As原子到B原子最近距离为__________(用含a的式子表示),该晶体的密度是___________________g.cm-3 (列出含a、
,As原子到B原子最近距离为__________(用含a的式子表示),该晶体的密度是___________________g.cm-3 (列出含a、![]() 的计算式即可)。
的计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com