
����Ŀ���ڹ�ҵ�ϳ�����ʱ����![]() ��
��![]() ��ԭ�Ͻ���������
��ԭ�Ͻ���������
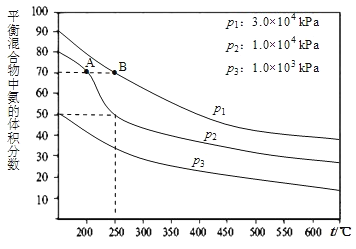
![]() ��ͼΪ�ϳɰ���Ӧ�������������������Ϊ1��3Ͷ��ʱ��ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£�ƽ�������а����������ͼ��
��ͼΪ�ϳɰ���Ӧ�������������������Ϊ1��3Ͷ��ʱ��ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£�ƽ�������а����������ͼ��
![]() ���ֱ���
���ֱ���![]() ��
��![]() ��ʾ�ӷ�Ӧ��ʼ����ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���
��ʾ�ӷ�Ӧ��ʼ����ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���![]() ______
______ ![]() ����
����![]() ������
������![]() ������
������![]() ��
��![]() ��
��
![]() ��
��![]() ��
��![]() �£�
�£�![]() ��ת����Ϊ
��ת����Ϊ
______ ![]() ����������С�����1λ
����������С�����1λ![]() ��
��
![]() ��
��![]() ��ˮ��
��ˮ��![]() ������������ϣ�����Ӧ������Һ�Լ��ԣ���Ӧ���Һ�и�����Ũ���ɴ�С��˳��Ϊ ______ ��
������������ϣ�����Ӧ������Һ�Լ��ԣ���Ӧ���Һ�и�����Ũ���ɴ�С��˳��Ϊ ______ ��
![]() ��
��![]() ����������Ӧ�������أ�������Ӧ�������仯ʾ��ͼ���£�
����������Ӧ�������أ�������Ӧ�������仯ʾ��ͼ���£�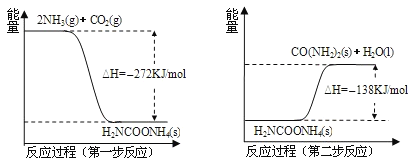
![]() ��
��![]() ��Ӧ�������ص��Ȼ�ѧ����ʽΪ ______ ��
��Ӧ�������ص��Ȼ�ѧ����ʽΪ ______ ��
![]() ��ҵ�Ϻϳ�����ʱ�����ܼӿ췴Ӧ���ʣ��������ԭ�������ʵĴ�ʩ�� ______
��ҵ�Ϻϳ�����ʱ�����ܼӿ췴Ӧ���ʣ��������ԭ�������ʵĴ�ʩ�� ______ ![]() �����
�����![]()
A.�����¶� ![]() �������
������� ![]() �����ؼ�ʱ�����ȥ
�����ؼ�ʱ�����ȥ ![]() ����Ӧ��ϵ��ѹǿ
����Ӧ��ϵ��ѹǿ
![]() ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ
ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ![]() ���ܱ�������Ͷ��4mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯��ͼ��ʾ��
���ܱ�������Ͷ��4mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯��ͼ��ʾ��
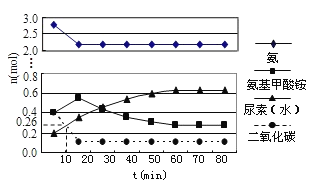
![]() ��֪�ܷ�Ӧ������ͨ��������һ����Ӧ��������ϳ������ܷ�Ӧ�������ɵ� ______ ����Ӧ������
��֪�ܷ�Ӧ������ͨ��������һ����Ӧ��������ϳ������ܷ�Ӧ�������ɵ� ______ ����Ӧ������
![]() ��Ӧ���е�10minʱ���
��Ӧ���е�10minʱ���![]() �����ʵ�����ͼ��ʾ������
�����ʵ�����ͼ��ʾ������![]() ��ʾ�ĵ�һ����Ӧ������
��ʾ�ĵ�һ����Ӧ������![]() ______ ��
______ ��
���𰸡�![]()
![]()
![]()
![]() D ��
D �� ![]()
��������
![]() �¶�Խ��ѹǿԽ��Ӧ����Խ��
�¶�Խ��ѹǿԽ��Ӧ����Խ��
![]() ��
��![]() ��
��![]() �£��������������Ϊ
�£��������������Ϊ![]() ����
����

����![]() ���Դ˼���ת���ʣ�
���Դ˼���ת���ʣ�
![]() ��
��![]() ��ˮ��
��ˮ��![]() ������������ϣ����߷�Ӧ����Һ�е�����Ϊ�����ʵ���Ũ�ȵİ�ˮ���Ȼ����Һ����Һ�ʼ��ԣ�˵��һˮ�ϰ�����̶ȴ���笠�����ˮ��̶ȣ�
������������ϣ����߷�Ӧ����Һ�е�����Ϊ�����ʵ���Ũ�ȵİ�ˮ���Ȼ����Һ����Һ�ʼ��ԣ�˵��һˮ�ϰ�����̶ȴ���笠�����ˮ��̶ȣ�
![]() ��ͼʾ��֪��������Ӧ����ɵ���ЧӦ��һ����ɵ���ЧӦ����ͬ�ģ�
��ͼʾ��֪��������Ӧ����ɵ���ЧӦ��һ����ɵ���ЧӦ����ͬ�ģ�
![]() �÷�Ӧ�����������С�ķ��ȷ�Ӧ�����ܼӿ췴Ӧ���ʡ��������ԭ�������ʵĴ�ʩ������ѹǿ��
�÷�Ӧ�����������С�ķ��ȷ�Ӧ�����ܼӿ췴Ӧ���ʡ��������ԭ�������ʵĴ�ʩ������ѹǿ��
![]() ��֪�ܷ�Ӧ�Ŀ���������һ�����������ͼ��仯���ƣ�ͼ����ﷴӦ���жϣ���Ӧ�����������ݵ�һ���͵ڶ�����Ӧ������б�ʱȽϴ�С��
��֪�ܷ�Ӧ�Ŀ���������һ�����������ͼ��仯���ƣ�ͼ����ﷴӦ���жϣ���Ӧ�����������ݵ�һ���͵ڶ�����Ӧ������б�ʱȽϴ�С��
![]() ����ͼ�����10����ʱ������̼���������ʵ�������ϻ�ѧ��Ӧ���ʸ������õ���
����ͼ�����10����ʱ������̼���������ʵ�������ϻ�ѧ��Ӧ���ʸ������õ���
![]() �¶�Խ��ѹǿԽ��Ӧ����Խ����ͼ��֪��B��Ӧ���¶ȡ�ѹǿ����Ӧ���ʴʴ�Ϊ��
�¶�Խ��ѹǿԽ��Ӧ����Խ����ͼ��֪��B��Ӧ���¶ȡ�ѹǿ����Ӧ���ʴʴ�Ϊ��![]() ��
��
![]() ��
��![]() ��
��![]() �£��������������Ϊ
�£��������������Ϊ![]() ����
���� 
![]() ��
��![]() ��������ת����
��������ת���� ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��
��![]() ��ˮ��
��ˮ��![]() ������������ϣ����߷�Ӧ����Һ�е�����Ϊ�����ʵ���Ũ�ȵİ�ˮ���Ȼ����Һ����Һ�ʼ��ԣ���Һ��
������������ϣ����߷�Ӧ����Һ�е�����Ϊ�����ʵ���Ũ�ȵİ�ˮ���Ȼ����Һ����Һ�ʼ��ԣ���Һ��![]() ��˵��һˮ�ϰ�����̶ȴ���笠�����ˮ��̶ȣ���ϵ���غ��
��˵��һˮ�ϰ�����̶ȴ���笠�����ˮ��̶ȣ���ϵ���غ��![]() ����������Ũ�ȴ�С˳����
����������Ũ�ȴ�С˳����![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��ͼʾ��֪��������Ӧ����ɵ���ЧӦ��һ����ɵ���ЧӦ����ͬ�ģ���������Ӧ��ӿɵ�
��ͼʾ��֪��������Ӧ����ɵ���ЧӦ��һ����ɵ���ЧӦ����ͬ�ģ���������Ӧ��ӿɵ�![]()
![]() ��
��
�ʴ�Ϊ��![]()
![]() ��
��
![]() �÷�Ӧ�����������С�ķ��ȷ�Ӧ�����ܼӿ췴Ӧ���ʡ��������ԭ�������ʵĴ�ʩ������ѹǿ����ѡD��
�÷�Ӧ�����������С�ķ��ȷ�Ӧ�����ܼӿ췴Ӧ���ʡ��������ԭ�������ʵĴ�ʩ������ѹǿ����ѡD��
![]() ��ͼ���֪��15�������ң������Ͷ�����̼��Ӧ���ɰ�������狀��ٱ仯�������ǵ�һ����Ӧ������������������ټ�С���ﵽƽ�⣬�������ǵڶ�����Ӧ��������б�ʲ��ѿ����ڶ�����Ӧ��������������֪�ܷ�Ӧ�Ŀ���������һ��������
��ͼ���֪��15�������ң������Ͷ�����̼��Ӧ���ɰ�������狀��ٱ仯�������ǵ�һ����Ӧ������������������ټ�С���ﵽƽ�⣬�������ǵڶ�����Ӧ��������б�ʲ��ѿ����ڶ�����Ӧ��������������֪�ܷ�Ӧ�Ŀ���������һ��������
�ʴ�Ϊ������
![]() ����ͼ�������������̼�ٽ��е�10minʱ���ʵ���Ϊ
����ͼ�������������̼�ٽ��е�10minʱ���ʵ���Ϊ![]() �����Դ�ʱ�ķ�Ӧ����
�����Դ�ʱ�ķ�Ӧ����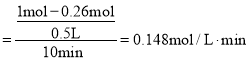 ��
��
�ʴ�Ϊ��![]() ��
��


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڳ����µ������Һ�������У���ȷ����( )
A.��![]()
![]() ��Һ�м�������
��Һ�м�������![]() NaOH��Һ�������Һ��
NaOH��Һ�������Һ��![]() ����ˮ�ĵ���̶ȱȴ�ˮ�Ĵ�
����ˮ�ĵ���̶ȱȴ�ˮ�Ĵ�
B.![]() ʱ��
ʱ��![]() ��
��![]() ��Һ����ˮ�������
��Һ����ˮ�������![]()
C.�����ʵ���Ũ�ȵ�![]() ��Һ��
��Һ��![]() ��Һ�У�
��Һ�У�![]() ǰ��С�ں���
ǰ��С�ں���
D.�����ʵ���Ũ�ȡ�������İ�ˮ�������Ϻ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��һѧ����ʵ���Ҳ�ij��Һ��pH��ʵ��ʱ������������ˮ��ʪpH��ֽ��Ȼ���ýྻ����IJ�����պȡ�������м�⡣
(1)��ѧ���IJ���___(������ȷ������������)����������___________��
(2)�ò����Ƿ�һ�������?______________________��
(3)���ô˷����ֱ�ⶨc(OH-)��ȵ�����������Һ�Ͱ�ˮ��pH�����ϴ����____��ԭ����___��
(4)ֻ�������Լ���ѡ��ʵ��������Լ������ܷ�����0.1mol��L-1������Һ��0.01mol��L-1������Һ��____����������������____________________________��
�Լ���A.��ɫʯ����Һ��B.��̪��Һ��C.������Һ��D.����ˮ��E.�Ȼ�����Һ��F.pH��ֽ
��.pH=2��A��B��������Һ��1mL���ֱ��ˮϡ�͵�1000mL����pH����Һ����Ĺ�ϵ��ͼ��ʾ��
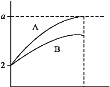
�ش�����������
(1)��a=5����AΪ___����BΪ___��(����ǿ����������)������ϡ��100������A��pH___7(����<����>������=��)��
(2)��A��B������������a�ķ�Χ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2.18g/cm3���е�131.4�����۵�9.79����������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ���п�������ͼ��ʾװ���Ʊ�1��2���������������з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Ũ��ˮ�����渲������ˮ����
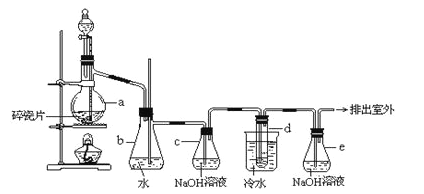
����д���пհף�
��1����ƿa�з��������Ҵ�����ˮ��Ӧ������ȥ��Ӧ����Ӧ�¶���170�������Ҹ÷�ӦҪ���¶�Ѹ�����ߵ�170������������������Ӧ����д���Ҵ�������ȥ��Ӧ�ķ���ʽ ��
��2��д���Ʊ�1��2����������Ļ�ѧ����ʽ�� ��
��3����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������ش�������ʱƿb�е����� ��
��4������c��NaOH��Һ�������ǣ� ��
��5���жϸ��Ʊ���Ӧ�Ѿ��������������___________________________��
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��d������ҪĿ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��S����Ҫ�ķǽ���Ԫ�أ���Ҫ��ش��������⣺
��1���̵����к��е�CO��SO2����Ҫ����Ⱦ����ڴ��������½�����ת��ΪS(s)��CO2���˷�Ӧ���Ȼ�ѧ����ʽΪ______________________________________________________��
��֪��CO(g)+1/2O2(g)=CO2(g) ��H=��283.0 kJ��mol��1
S(s)+O2(g)=SO2(g) ��H=��296.0 kJ��mol��1��
��2����ס���������Ϊ1 L���ܱ������У��ֱ����5 mol SO2��3 mol O2��������Ӧ��2SO2(g)+
O2(g)![]() 2SO3(g) ��H��0�����������¶�ΪT1�������·�Ӧ���ﵽƽ��ʱSO3�����ʵ���Ϊ4.5 mol�����������¶�ΪT2�������·�Ӧ���ﵽƽ��ʱSO3�����ʵ���Ϊ4.6 mol����T1___T2�����������������������������з�Ӧ��ƽ�ⳣ��K=_____________________��
2SO3(g) ��H��0�����������¶�ΪT1�������·�Ӧ���ﵽƽ��ʱSO3�����ʵ���Ϊ4.5 mol�����������¶�ΪT2�������·�Ӧ���ﵽƽ��ʱSO3�����ʵ���Ϊ4.6 mol����T1___T2�����������������������������з�Ӧ��ƽ�ⳣ��K=_____________________��
��3����ͼ��ʾ��A�Ǻ��ݵ��ܱ�������B��һ������ɱ�ij������ҡ����ֺ��£��ر�K2���ֱ�1 mol N2��3 mol H2ͨ��K1��K3����A��B�У������ķ�ӦΪ��N2(g)+3H2(g) ![]() 2NH3(g)����ʼʱA��B�������ͬ��Ϊa L��
2NH3(g)����ʼʱA��B�������ͬ��Ϊa L��

������ʾ��ͼ����˵��A�����з�Ӧ�ﵽƽ��״̬������˵��B�����з�Ӧ�ﵽƽ��״̬����______��

������A�з�Ӧ����ƽ��ʱ����ʱ��t s���ﵽƽ���������ѹǿ��Ϊԭ����5/6����ƽ����Ӧ������(H2)=___________________________��
��4����0.1 mol�����ֱ�ͨ��1 L pH=1�����ᡢ����ʹ�����Һ�У���ȫ��Ӧ������Һ��NH4+����Ũ�ȷֱ�Ϊc1��c2��c3��������Ũ�ȴ�С�Ĺ�ϵΪ____________������c1��c2��c3�ͣ�������=����ʾ������֪�������Һ�����ԣ�������CH3COOH��Ka=1��10��5 mol��L��1������¶���NH4Cl��ˮ�ⳣ��K h Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�̼���������Ԫ�ػ���������ʻ�ת���Խ�����̬�����������й�������Ҫ����.
(1)��ˮ����̼�Ĵ�����ʽ���ֲ�����ͼ��ʾ��
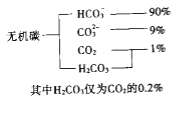
�����ӷ���ʽ��ʾ��ˮ�������Ե�ԭ��______________.��֪������ˮpH=8.1��Ԥ���ļ���ˮ���Խ���_____________(��д����ǿ������������)��������_________________________.
(2)��ҵ����CO��H2Ϊԭ�Ϻϳɼ״��ķ�Ӧ��CO(g)+2H2(g)CH3OH(g) ��H<0�����ݻ�Ϊ1L�ĺ��������У��ֱ���T1��T2��T3�����¶��ºϳɼ״�.��ͼ�����������¶��²�ͬH2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1mol)��COƽ��ת���ʵĹ�ϵ.����˵����ȷ����_______________.
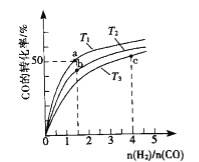
A.a��b��c����H2ת���ʣ�c>a>b
B.���������¶�֮���ϵΪT1>T2>T3
C.a��״̬����ͨ��0.5 mol co��0.5 mol CH3OH��ƽ�ⲻ�ƶ�
D.c��״̬����ͨ��1 mol co��4mol H2����ƽ����H2�������������
(3)NO���ٳ����㱻�ƻ����䷴Ӧ������ͼ��ʾ��
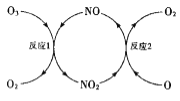
��NO��������___________________��
����֪:O3(g)+0(g)=202(g) ��H=-143kJ��mol-l
��Ӧ1: O3(g)+NO(g)NO2(g)+O2(g) ��H1=-200.2kJ��mol-l
��Ӧ2���Ȼ�ѧ����ʽΪ_____________________��
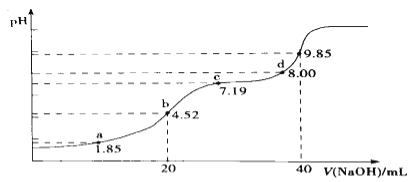
(4)������Ⱦ��SO2����NaOH����.��֪pKa=-lgKa,25��ʱ��H2SO3��pKa1=1.85��pKa2=7.19�����¶�����0.1mol�� L-1 NaOH��Һ�ζ�20mL0.1mol��L-1H2SO3��Һ�ĵζ�������ͼ��ʾ.b��������Һ�и�����Ũ���ɴ�С��˳����________________��c��������Һ�У�c(Na+)___________3c(HSO3-)(����>������<������=��).
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������Ӧ����������ʵ����
ѡ�� | ʵ����� | ���� |
A | ��ʢ�� | ��Һ��Ϊ��ɫ���μ�KSCN����Һ��Ѫ��ɫ |
B | ��ʢ�� | ��Һ����ɫ�����ú�۲쵽��Һ�зֲ����� |
C | �� | �Ȳ�����ɫ�������������ʧ |
D | ��ʢ�� | �д̼�����ζ�����������Һ����� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾʵ���������
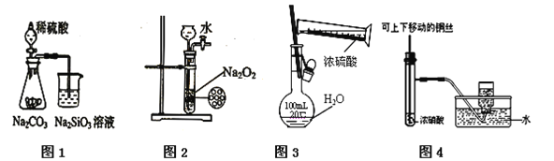
A. ͼ1Ϊ֤���ǽ�����ǿ����S > C > Si
B. ͼ2Ϊ�Ʊ���������
C. ͼ3Ϊ����һ�����ʵ���Ũ�ȵ�������Һ
D. ͼ4Ϊ�Ʊ����ռ�����NO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȵ�ϡ![]() �з�Ӧ������Ҫ��ԭ����Ϊ
�з�Ӧ������Ҫ��ԭ����Ϊ![]() ���������ϡ
���������ϡ![]() �з�Ӧ������Ҫ��ԭ����ΪNO������Һ��ϡʱ���仹ԭ����Ϊ
�з�Ӧ������Ҫ��ԭ����ΪNO������Һ��ϡʱ���仹ԭ����Ϊ![]() ���������ͼ���ش��й����⡣
���������ͼ���ش��й����⡣
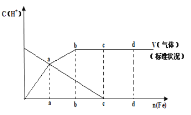
![]() ��������һ������������߶���ֻ��һ�ֻ�ԭ�������ƽ��b�㵽c��ʱ�Ļ�ѧ��Ӧ����ʽ��_____Fe+____HNO3��____Fe(NO3)3+_________+____H2O
��������һ������������߶���ֻ��һ�ֻ�ԭ�������ƽ��b�㵽c��ʱ�Ļ�ѧ��Ӧ����ʽ��_____Fe+____HNO3��____Fe(NO3)3+_________+____H2O
![]() �жϴ�o�㵽a��ʱ�Ļ�ԭ���Ӧ��___________
�жϴ�o�㵽a��ʱ�Ļ�ԭ���Ӧ��___________
![]() �㵽b��ʱ������ԭ����Ϊ_________����ԭ����______________
�㵽b��ʱ������ԭ����Ϊ_________����ԭ����______________
![]() ��֪�ﵽd��ʱ��Ӧ��ȫ��������ʱ��Һ�е���Ҫ������Ϊ____________��
��֪�ﵽd��ʱ��Ӧ��ȫ��������ʱ��Һ�е���Ҫ������Ϊ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com