
【题目】C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1。
(2)向甲、乙两个均为1 L的密闭容器中,分别充入5 mol SO2和3 mol O2,发生反应:2SO2(g)+
O2(g)![]() 2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3 mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g) ![]() 2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。

①下列示意图既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。

②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率υ(H2)=___________________________。
(4)将0.1 mol氨气分别通入1 L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为____________(用“c1、c2、c3和>、<、=”表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,求该温度下NH4Cl的水解常数K h 为_________。
【答案】2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH= -270 kJ·mol-1 > 108 L·mol-1或108 d 1/at mol·L-1·s-1 c1=c2<c3 10-9 mol/L或10-9
【解析】
本题考查热化学方程式的书写,利用三段式进行,化学平衡常数的计算,溶液中离子浓度的大小关系以及盐类的水解等知识,综合性较强,有一定难度。
(1)①CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
根据盖斯定律,反应①×2-反应②即可,2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ·mol-1
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ·mol-1 。
(2)因为反应正向为放热,所以三氧化硫增多,说明平衡正向移动,温度降低,选>
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始物质的量5 3 0
改变物质的量4.5 2.25 4.5
平衡物质的量0.5 0.75 4.5
的密闭容器的体积为1 L,根据方程式计算得,平衡时二氧化硫的浓度为0.5mol/L,氧气的浓度为0.75mol/L,三氧化硫的浓度为4.5molL,所以平衡常数=4.5×4.5/(0.5×0.5×0.75)=108L·mol-1或108;
故答案为:108 L·mol-1或108。
(3)①a、A中气体的密度始终不变,而B中的密度随体积变化而变化,平衡时不变;
b、反应过程中平衡常数始终不变,不能说明平衡;
c、正反应起点最大,所以错误;
d、氮气的转化率逐渐增大,最后不变,说明反应到平衡。
选d。
② N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始物质的量1 3 0
改变物质的量x 3x 2x
平衡物质的量1-x 3-3x 2x
(1-x+3-3x+2x)/(1+3)=5/6解x=1/3所以氢气的反应速率=1/atmol·L-1·S-1。
故答案为:1/atmol·L-1·S-1。
(4)盐酸和硫酸完全反应,醋酸有剩余,对铵根离子水解抑制作用,所以在醋酸溶液中铵根离子浓度最大,关系为c1=c2<c3,因为醋酸铵为中性,说明醋酸的电离程度=氨水的电离程度,铵盐的水解平衡常数=10-14/10-5=10-9;故答案为:10-9 mol/L或10-9 。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abcB.bcdC.cbdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)能判断反应达到平衡状态的依据是__________(填字母序号)。
A.2 ν逆(H2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
F.CO、H2、CH3OH的速率之比为1:2:1
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H_______0(填“>”或“<”)
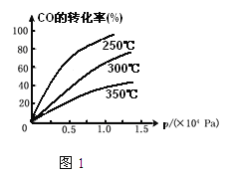
(3)一定温度下,将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为_______________。
②若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,判断平衡移动的方向是_______________(“正向移动”、“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的![]() ,与原平衡相比,下列有关说法正确的是_____________(填字母)。
,与原平衡相比,下列有关说法正确的是_____________(填字母)。
A.H2的浓度减小; B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加; D.重新平衡时,![]() 增大;
增大;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式中正确的是( )
A. 盐酸与碳酸钡反应:CO32-+2H+ = CO2↑+H2O
B. 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++SO42-= BaSO4↓
C. 澄清石灰水与少量小苏打溶液混合:Ca2+ + OH-+ HCO3-= CaCO3↓ + H2O
D. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_____;
(2)写出②的离子化学方程式____;
(3)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为____;
(4)反应②中氯化氢表现出的性质是____。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如下图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。 “纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与金刚石互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。许多科学家认为从空气中捕获二氧化碳不仅在理论上可行,很快还会成为一个对付全球变暖的实用武器;目前 NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是_________。
A.NH4Cl B.CH3CH2OH C.CaCl2 D.Na2CO3
(2)工业上用NH3捕碳可合成CO (NH2)2:已知:①标准状况下,5.6L NH3与足量CO2完全反应生成NH2CO2 NH4 (s)时放出39.8kJ的热量;②NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) △H=+72.5 KJ·mol-1,则2NH3(g)+CO2(g)=CO(NH2)2(s)+ H2O(g)的△H=_________KJ·mol-1。
(3)用(NH4)2CO3捕碳的反应如下:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图(见下图):
2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图(见下图):

①c点的逆反应速率和d点的正反应速率的大小关系为V逆c ____V正d (填“>”、“=”或“<”)。
②b、c、d三点的平衡常数K b、K c、Kd 从小到大的顺序为_______(填“>”、“=”或“<”)。
③在T2~T4温度区间,容器内CO2气体浓度呈现先减小后增大的变化趋势,其原因是______________。
(4)用碱性溶液也可捕碳:在常温下,将0.04molCO2通入200mL0.2mol/L的Na2S溶液中,已知:H2CO3的电离平衡常数:K1=4.3×10—7、K2=5.6×10—11;H2S的电离平衡常数:K1=5.0×10—8、K2=1.1×10—12。回答下列问题:
①发生反应的离子方程式为___________。
②充分反应后下列关系式中正确的是 ___________。
A.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
B.(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
③计算反应后的溶液中c(H2S)c(OH-)/ c(HS-)的值为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO![]() 和泥沙,可将粗盐溶于水,然后进行下列五项操作:
和泥沙,可将粗盐溶于水,然后进行下列五项操作:
①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
通过教材中“粗盐的提纯”及你做过的该实验回答下列问题:
(1)以上五步操作中,最后进行的是________。
(2)实验室进行NaCl溶液的蒸发时,一般有以下操作过程:
①固定铁圈位置 ②放置酒精灯 ③放上蒸发皿(蒸发皿中盛有NaCl溶液) ④加热搅拌 ⑤停止加热
正确的操作顺序为___________________。
(3)在粗盐经过一系列操作后的溶液中滴加过量饱和Na2CO3溶液。请问这步操作的目的是___________________________________________。判断Na2CO3溶液已经过量的方法是_________________________________________________________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:_________________________________________。
过滤时:_________________________________________。
蒸发时:_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com