
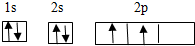
 ,Z为N,N的基态原子的简化电子排布式为:[He]2s22p3,故答案为:
,Z为N,N的基态原子的简化电子排布式为:[He]2s22p3,故答案为: ;[He]2s22p3;
;[He]2s22p3;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
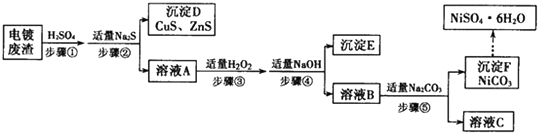
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 |
| B、可用四氯化碳萃取溴水中的溴 |
| C、在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 |
| D、作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
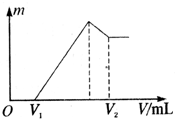 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物理量 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | |||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | |||
| ① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| ② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.010 | 4.0 | 25 | |||
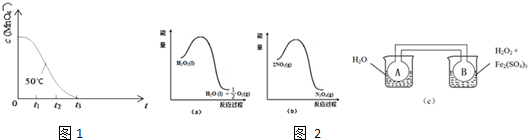
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com