
【题目】能把乙醇、甲酸、乙酸、葡萄糖溶液用一种下列试剂区分开的是( )
A. 新制氢氧化铜浊液 B. 碳酸钠溶液 C. 酸性高锰酸钾溶液 D. 紫色石蕊试液
科目:高中化学 来源: 题型:
【题目】(2016·新课标全国卷Ⅰ)元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
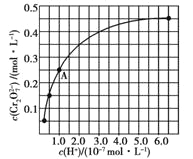
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH__0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 由水电离出的c(H+)=1×10-13 mol/L的溶液:Al3+、K+、SO42-、Cl-
C. c (OH-)/c(H+)=1012的溶液中:Na+、SO42-、NO3-、HCO3-
D. 滴加KSCN变红色的溶液:Na+、K+、Al3+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都为短周期元素,A 原子失去一个电子后成为一个质子;C 的-1 价阴离子与氖原子具有相同的电子层结构;D在C 的下一周期,D可与同周期的B形成 BD2型离子化含物;E 和 C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是____________。
(2)A与 E 形成的最简单化合物的电子式为____________。
(3)C的氢化物与 D的氢化物的沸点相比较: ____________(用化学式表示,且用>符号连接)。 解释原因______________。
(4)E 的氢化物与 E 的最高价氧化物对应水化物反应的生成物中含有的的化学键有____________。
(5)E 的最高价氧化物对应的水化物的稀溶液与过量铁粉发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型有机酰胺化合物M在工业生产中有重要的应用,其合成路线如下;

①A的相对分子质量为58,含氧的质量分数为0.552,已知核磁共振氢谱显示为一组峰,可发生银镜反应

其化回答下列问题:
(1)A的名称为_____________,C中含有官能团名称为__________________________
(2)F的结构简式为________________________________________
(3)B→C的反应类型为_________________,G→H的反应类型为____________
(4)F+H→M的化学方程式为_________________________________________________
(5)芳香族化合物W有三个取代基,是C的同分异构体,能与FeCl3溶液发生显色反应,0.5molW可与足量的Na反应生成1克H2,W共有______种同分异构体,其中核磁共振氢谱为五组峰的结构简式为_______________________
(6)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备![]() 的合成路线_________________________________________________________________
的合成路线_________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X比Y多一个但比Z少一个,原子的电子层数X比Y、Z少一层。下列说法正确的是
A. 原子半径的大小为:Z>Y>X>W
B. 若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者
C. 元素的非金属性:Y>Z
D. 若X的单质为常见的非金属导体,则Y的简单离子能破坏水的电离平衡
【答案】D
【解析】根据题意W是H元素;X、Y、Z在元素周期表的相对位置是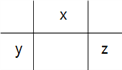 ;原子半径的大小为:Y>Z>X>W,故A错误;若Y、Z的核电荷数之和为X的4倍,则X、Z分别是O、Cl,的气态氢化物的沸点:H2O>HCl,故B错误;同周期元素从左到右非金属性增强,元素的非金属性:Y<Z,故C错误;若X的单质为常见的非金属导体,X是碳元素, Y是Al元素,Al3+水解促进水的电离,故D正确。
;原子半径的大小为:Y>Z>X>W,故A错误;若Y、Z的核电荷数之和为X的4倍,则X、Z分别是O、Cl,的气态氢化物的沸点:H2O>HCl,故B错误;同周期元素从左到右非金属性增强,元素的非金属性:Y<Z,故C错误;若X的单质为常见的非金属导体,X是碳元素, Y是Al元素,Al3+水解促进水的电离,故D正确。
【题型】单选题
【结束】
6
【题目】特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2![]() C6+LiCoO2,下列说法不正确的是
C6+LiCoO2,下列说法不正确的是
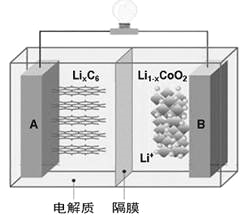
A. 据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边移向右边
B. 放电时,正极锂的化合价未发生改变
C. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收
D. 充电时阳极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①9.8gH2SO4的物质的量为_____mol,约含有_____个H2SO4分子。
②标准状况下,22.4LH2的质量为______g。
③将30mL0.5mol/LNaCl溶液加水稀释到500mL,稀释后NaCl溶液的物质的量浓度为__________mol/L。
④摩尔质量的符号为_______,单位是__________(符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列配制的溶液浓度偏高的是( )
A.配制硫酸用量筒量取硫酸时俯视刻度线
B.配制盐酸定容时,仰视容量瓶刻度线
C.NaOH溶解后未经冷却即注入容量瓶至刻度线
D.称量4gNaOH配制0.1mol/L NaOH溶液1000mL时,砝码错放左盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com