
| A、用托盘天平称取8gNaOH固体(NaOH固体放置于天平的托盘上),放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D、用50mL量筒量取40mL5mol/LNaOH溶液,倒入100mL容量瓶中,然后加蒸馏水定容直至刻度线,盖好瓶塞,反复摇匀,装瓶就行 |


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银、干冰、硫酸、烧碱、食盐 |
| B、碘酒、冰、盐酸、烧碱、食盐 |
| C、氢气、二氧化硫、硝酸、纯碱、硝酸钾 |
| D、铜、氧化铜、醋酸、石灰水、氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
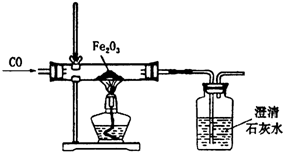 某课外活动小组在实验室条件下探究CO与Fe2O3反应的产物情况,实验设计如图所示.
某课外活动小组在实验室条件下探究CO与Fe2O3反应的产物情况,实验设计如图所示.| 加热时间/min | 0 | 10 | 60 | 120 | 130 |
| 固体质量/g | 24.0 | 23.2 | 21.6 | 16.8 | 16.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com