
| A、银、干冰、硫酸、烧碱、食盐 |
| B、碘酒、冰、盐酸、烧碱、食盐 |
| C、氢气、二氧化硫、硝酸、纯碱、硝酸钾 |
| D、铜、氧化铜、醋酸、石灰水、氯化铜 |


科目:高中化学 来源: 题型:
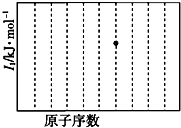 a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:| 元素 | 元素相关信息 |
| a | 其单质的熔点97.81℃,沸点882.9℃,在氧气中燃烧得到淡黄色固体 |
| b | 原子核外有7种运动状态不同的电子 |
| c | 电负性最大 |
| d | 一种核素的质量数为35,中子数为18 |
| e | 基态原子的核外电子排布中未成对的电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
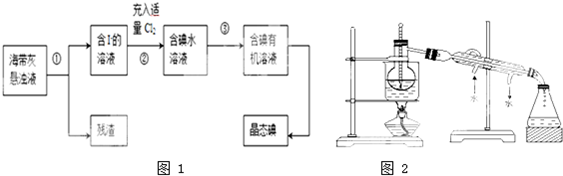
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取8gNaOH固体(NaOH固体放置于天平的托盘上),放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D、用50mL量筒量取40mL5mol/LNaOH溶液,倒入100mL容量瓶中,然后加蒸馏水定容直至刻度线,盖好瓶塞,反复摇匀,装瓶就行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | 加入试剂 | 离子方程式 |
| Cu2+ | ||
| SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取7.68 g硫酸铜,加入500 mL水 |
| B、称取12.5 g胆矾配成500 mL溶液 |
| C、称取8.0 g硫酸铜,加入500 mL水 |
| D、称取12.0 g胆矾配成500 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲酸(CH2O2),俗称蚁酸,结构式为:
甲酸(CH2O2),俗称蚁酸,结构式为: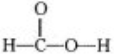 .某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
.某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
查看答案和解析>>
科目:高中化学 来源: 题型:
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
| A、该晶体结构与ZnS晶体相似 | |||||
| B、该晶体每个晶胞中有2个A2+和B2- | |||||
C、该晶体晶胞的边长
| |||||
| D、A2+离子紧邻的B2-构成的空间结构为正方体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
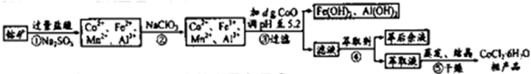
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com