
【题目】化合物F是一种食品保鲜剂,可按如下途径合成:

已知:RCHO+CH3CHO![]() RCH(OH)CH2CHO。
RCH(OH)CH2CHO。
试回答:
(1)A的结构简式是_________,E→F的反应类型是_________。
(2)B→C反应的化学方程式为_____________。
(3)C→D所用试剂和反应条件分别是_________。E中官能团的名称是________________。
(4)检验F中碳碳双键的方法是_________________________。
(5)连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有______种(除D外)。其中苯环上只有一个取代基,核磁共振氢谱有4个峰,峰面积比为3∶2∶2∶1的同分异构体的结构简式为____________。
【答案】![]() 消去反应
消去反应 ![]() +NaOH
+NaOH![]()
![]() +NaCl O2/Cu或Ag,加热 羟基、醛基 用Br2的CCl4溶液或先加足量银氨溶液或新制氢氧化铜,充分反应后,酸化后再用溴水检验碳碳双键 8
+NaCl O2/Cu或Ag,加热 羟基、醛基 用Br2的CCl4溶液或先加足量银氨溶液或新制氢氧化铜,充分反应后,酸化后再用溴水检验碳碳双键 8 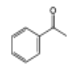
【解析】
根据流程图,E脱水生成![]() ,利用逆推法,E是
,利用逆推法,E是![]() ;根据RCHO+CH3CHO
;根据RCHO+CH3CHO![]() RCH(OH)CH2CHO,
RCH(OH)CH2CHO, ,可逆推出D是
,可逆推出D是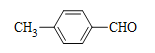 ;根据B的分子式C8H9Cl,结合D的结构,B是
;根据B的分子式C8H9Cl,结合D的结构,B是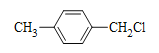 ;C是
;C是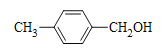 ,则A是
,则A是![]() 。
。
(1)根据上述分析,A的结构简式是![]() ;E(
;E(![]() )分子内脱水生成F(
)分子内脱水生成F(![]() ),则反应类型为消去反应,故答案为:
),则反应类型为消去反应,故答案为:![]() ;消去反应;
;消去反应;
(2) 在氢氧化钠溶液中水解为
在氢氧化钠溶液中水解为 ,反应的化学方程式为
,反应的化学方程式为 +NaOH
+NaOH![]()
![]() +NaCl,故答案为:
+NaCl,故答案为: +NaOH
+NaOH![]()
![]() +NaCl;
+NaCl;
(3) 在铜或银作催化剂的条件下加热,能被氧气氧化为
在铜或银作催化剂的条件下加热,能被氧气氧化为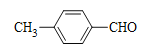 ,所以试剂和反应条件是O2/Cu或Ag,加热;
,所以试剂和反应条件是O2/Cu或Ag,加热;![]() 中含有的官能团有羟基和醛基;故答案为:O2/Cu或Ag,加热;羟基、醛基;
中含有的官能团有羟基和醛基;故答案为:O2/Cu或Ag,加热;羟基、醛基;
(4)双键可以发生加成反应,所以可以用溴的四氯化碳溶液检验,因为F中还含有醛基,容易被氧化,所以不能用高锰酸钾溶液检验;也可以先加足量银氨溶液或新制氢氧化铜,充分反应后,酸化后再用溴水检验碳碳双键;故答案为:用Br2的CCl4溶液或先加足量银氨溶液或新制氢氧化铜,充分反应后,酸化后再用溴水检验碳碳双键;
(5)连在双键碳原子上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有 、
、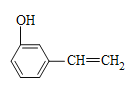 、
、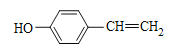 、
、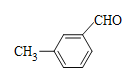 、
、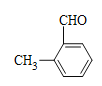 、
、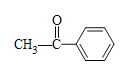 、
、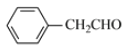 、
、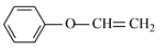 ,共8种;其中苯环上只有一个取代基,核磁共振氢谱有4个峰,峰面积比为3∶2∶2∶1的同分异构体的结构简式为
,共8种;其中苯环上只有一个取代基,核磁共振氢谱有4个峰,峰面积比为3∶2∶2∶1的同分异构体的结构简式为 ,故答案为:8;
,故答案为:8; 。
。


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中不正确的是 ![]()
A.等物质的量浓度的下列溶液中![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() 由大到小的顺序是
由大到小的顺序是![]()
B.![]() 时,
时,![]() 溶液
溶液![]() 和
和![]() 溶液
溶液![]() 混合,若
混合,若![]() ,则混合溶液的pH一定小于7
,则混合溶液的pH一定小于7
C.室温下,向![]() 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性:![]()
D.对于反应![]()
![]() ,理论上在任何温度下都能自发进行
,理论上在任何温度下都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球碳计划组织(GCP,The Global Carbon Project)报告称,2018年全球碳排放量约371亿吨,达到历史新高。
(1)中科院设计了一种新型的多功能复合催化剂,实现了CO2直接加氢制取高辛烷值汽油,其过程如图1所示。
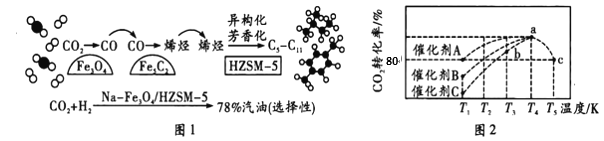
①已知:CO2(g)+H2(g)=CO(g)+H2O(g) △H= + 41 kJ·mol-1
2CO2(g)+6H2(g)=4H2O(g)+CH2=CH2(g) △H= -128 kJ·mol-1
则上述过程中CO和H2转化为CH2=CH2的热化学方程式是_________。
②下列有关CO2转化为汽油的说法,正确的是___________________(填标号)。
A. 该过程中,CO2转化为汽油的转化率高达78%
B. 中间产物Fe5C2的生成是实现CO2转化为汽油的关键
C. 在Na-Fe3O4上发生的反应为CO2+H2=CO+H2O
D. 催化剂HZSM-5可以提高汽油中芳香烃的平衡产率
③若在一容器中充入一定量的CO2和H2,加入催化剂恰好完全反应,且产物只生成C5以上的烷烃类物质和水。则起始时CO2和H2的物质的量之比不低于_________。
(2)研究表明,CO2和H2在一定条件下可以合成甲醇。反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
①该反应自发进行的条件是__________(填“高温”“低温”或“任意温度”)
②催化效果最佳的催化剂是__________(填“A”“B”或“C”);b点时,![]() ________
________![]() (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③若容器容积保持不变,则不能说明该反应达到化学平衡状态的是________。
a.c(CO2)与c(H2)的比值保持不变
b.v(CO2)正=v(H2O)逆
c.体系的压强不再发生变化
d.混合气体的密度不变
e.有lmolCO2生成的同时有断开3mol的H-H键
f.气体的平均相对分子质量不变
④已知容器内的起始压强为100 kPa,若图2中c点已达到平衡状态,则该温度下反应的平衡常数Kp =____________________(只列出计算式,不要求化简,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分:(不得用a~h字母回答)元素周期表有7个横行,每一个横行称为“周期”,周期序数=电子层数;元素周期表共有18列,每一列称为 “族”,下表中的7列为主族元素,分别用罗马数字Ⅰ、Ⅱ、……表明族序数,族序数=最外层电子数。
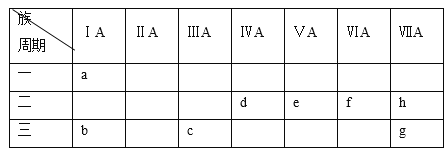
根据a~h各元素的性质,选择相应的化学符号、化学式或化学方程式填空:
(1)单质氧化性最强的是__________,酸性最强的含氧酸是_____________。
(2)写出e的碱性气态氢化物的电子式_____,将它和化合物df 2通入饱和食盐水发生反应的化学方程式是_____。
(3)最高价氧化物对应的水化物中,碱性最强的是___________。
(4)在b、c、g、h中,常见离子半径最大的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下发生如图所示的物质之间的变化:
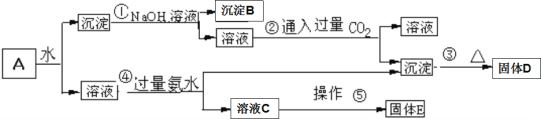
(1)固体D的化学式为___________
(2)写出反应①、④的离子方程式________________、_____________
(3)溶液C中含有的主要离子是______________________
(4)操作⑤是__________、______________________
(5)如图表示AlCl3与NaOH溶液相互滴加的两组实验过程中,微粒数量的关系曲线。判断下列说法不正确的是_____________
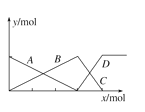
A.A线可表示Al3+或OH—的物质的量的变化
B.B C D线均可表示AlO2—的物质的量的变化
C.B C D线均可表示Al(OH)3的物质的量的变化
D.同一组实验中A、B、C、D线不可能全部出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某知名企业开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5+xLi![]() LixV2O5。下列说法中正确的是( )
LixV2O5。下列说法中正确的是( )
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时做阳极
C.该电池充电时阳极的反应为LixV2O5-xe-=V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有纯净的NH3,含一半空气的HCl气体, NO2 和O2的混合气体[V(NO2)∶V(O2) = 4∶1 ],然后分别作喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com