
【题目】下列关于钠的说法中不正确的是( )
A.金属钠和氧气反应,条件不同,产物则不同
B.钠长期放置在空气中,最终将变成碳酸钠
C.钠的化学性质比较活泼,少量的钠可以保存在煤油中
D.当钠着火时可用水扑灭
【答案】D
【解析】
A.常温下钠与氧气反应:4Na+O2=2Na2O,加热条件下与氧气反应2Na+O2![]() Na2O2,条件不同,产物则不同,故A正确;
Na2O2,条件不同,产物则不同,故A正确;
B.钠放置于空气中发生银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO310H2O)→最后变成Na2CO3(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,
故B正确;
C.钠的密度比煤油大,且与煤油不反应,可保存在煤油中,故C正确;
D.钠性质活泼,与水发生剧烈反应生成氢氧化钠和氢气,所以钠着火时可用沙土盖灭,故D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学反应的离子方程式,或根据离子方程式,写一个符合条件的化学方程式。
①碳酸镁和足量稀盐酸反应______________________。
②碳酸氢钠与硫酸反应__________________________。
③MnO2+4HCl![]() MnCl2+Cl2↑ +2H2O_____________________。
MnCl2+Cl2↑ +2H2O_____________________。
④Zn+2Ag+=Zn2++2Ag _______________________。
⑤CO32- + 2H+=H2O + CO2↑_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有几种芳香族化合物的结构如下所示,
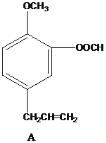
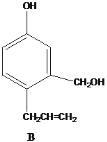
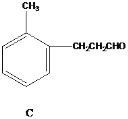

请回答下列问题:
(1)写出A中无氧官能团的名称____,写出C与银氨溶液反应的化学反应方程式___________ 。
(2)能发生银镜反应的物质有____(填序号)。
(3)D的同分异构体有多种,请写出核磁共振氢谱峰面积之比为3:2:2:1的结构简式___(写出1种即可)。
(4)B与足量浓溴水反应,所得产物的结构简式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组设计了如下图所示的实验装置用于制备ClO2。
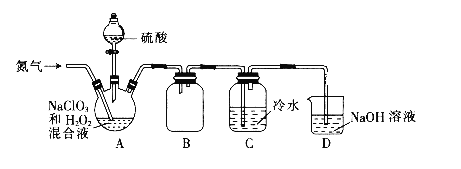
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________。
②装置B的作用是_________。
③当看到装置C中导管液面上升时应进行的操作是________。
(2)用0.1000mol·L-1的Na2S2O3标准液测定装置C中ClO2溶液的浓度。原理:2ClO2+10I-+8H+=5I2+2Cl-+4H2O , I2+2S2O32- = 2I- +S4O62-
①配制0.1000molL-1的Na2S2O3标准溶液时所需仪器除在如图所示的仪器中进行选择外,还需用到的玻璃仪器是________(填仪器名称)
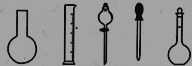
②在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1000molL-1(填“>”、“<”或“=”,下同);若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___0.1000molL-1。
③取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________作指示剂,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应时,Na、NaOH、NaHCO3的物质的量之比为( )
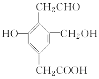
A. 3∶3∶2B. 3∶2∶1
C. 1∶1∶1D. 3∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化对工农业生产及环境保护有重要的意义。
(1)下面是氮的氧化物在几种不同情况下的转化:
①已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJ·mol-1
2NO2(g) ΔH=-113.0kJ·mol-1
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为___。
②a.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使其反应达到平衡,正反应速率随时间变化的示意图如图1所示。反应在c点___(填“达到”或“未到”)平衡状态。
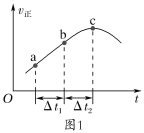
b.开始时,分别在该容器中加入Ⅰ:2molSO2(g)和2molNO2(g);Ⅱ:2molSO3(g)和2molNO(g)。则反应达到平衡时,平衡常数:Ⅰ__(填“>”“=”或“<”)Ⅱ。
(2)常温时向浓度为0.1mol·L-1体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸体积的变化曲线如图2所示,d点处两种溶液恰好完全反应。根据图2回答下列问题:
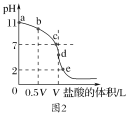
①b、c、d三点对应的溶液中,水电离的c(OH-)由大到小的顺序为____。
②滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有___。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
③该温度时氨水的电离平衡常数K=___。
(3)氮的氧化物易污染环境,可用氢氧化钠溶液吸收。发生的反应为:
2NaOH+NO+NO2=2NaNO2+H2O
2NaOH+2NO2=NaNO3+NaNO2+H2O
将反应混合液和氢氧化钠溶液分别加到如图3所示的电解槽中进行电解,A室产生N2。
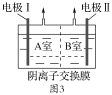
①电极Ⅱ是__极,B室产生的气体是___。
②A室NO2-发生的电极反应是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com