



 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
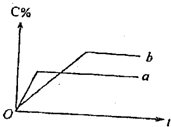 如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )
如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )| A、其他条件相同,a表示使用了催化剂,b表示没有使用催化剂 |
| B、其他条件相同,若只改变温度,则a比b的温度高且正反应吸热 |
| C、其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| D、其他条件相同,若只改变A物质的量,则a比b用A物质的量少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 5.0 | 10.0 | 15.0 |
| 生成气体的体积/mL(标准状况) | 44.8 | 89.6 | 112 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来,碳和碳的化合物在生产生活实际中应用广泛.
近年来,碳和碳的化合物在生产生活实际中应用广泛.| t(℃) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
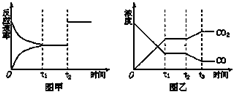 已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,
已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,| T(K) | K1 | K2 |
| 700 | 1.47 | 2.38 |
| 900 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电源中a为正极,b为负极 |
| B、试管A中的电极反应式为:2H++2e-=H2↑ |
| C、一段时间后滤纸条上紫红色向C处移动 |
| D、电解一段时间后,切断K2、K3,闭合K1,电流计的指针会发生偏转 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com